题目内容
15. 喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).
喷泉是一种常见的自然现象,其产生的原因是存在压强差.制取氨气并完成喷泉实验(图中夹持装置均已略去).(1)写出实验室制取氨气的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O.
(2)收集氨气应使用向下排空气法法.
(3)要得到干燥的氨气可选用下列B 做干燥剂.
A.浓硫酸 B.碱石灰 C.无水CaCl2 D.P2O5固体
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发喷泉实验的操作是将胶头滴管中的水挤入烧瓶中,松开弹簧夹.
分析 (1)实验室用加热铵盐和碱的固体混合物制取氨气;
(2)根据氨气密度和溶解性分析解答;
(3)干燥气体时必须满足:气体不能与干燥剂反应;
(4)喷泉实验利用的原理是产生压强差.
解答 解:(1)实验室用加热氯化氨和消石灰的固体混合物制取氨气,方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O;
(2)氨气的密度比空气小,极易溶于水,只能用向下排气法收集,故答案为:向下排空气法;
(3)浓硫酸具有酸性,五氧化二磷为酸性氧化物,氨气是碱性气体,所以浓硫酸和五氧化二磷都不能干燥氨气,氯化钙与氨气结合生成络合物,
故答案为:B;
(4)氨气是一种极易溶于水的气体,将胶头滴管中的水挤入烧瓶中,瓶内压强减小,在外界气压的作用下,水被压到瓶内,形成喷泉现象,
故答案为:将胶头滴管中的水挤入烧瓶中,松开弹簧夹.
点评 本题考查实验装置的综合及氨气的性质,为高频考点,把握实验装置的作用、喷泉实验原理为解答的关键,侧重分析与实验能力的考查,注意压强差的产生,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入某气体仍无沉淀,则该气体可能是( )
| A. | Cl2 | B. | NH3 | C. | NO2 | D. | CO2 |
20.实验报告中,以下数据合理的是( )
| A. | 用碱式滴定管量取25.03mLH2SO4溶液 | |
| B. | 用50mL量筒量取21.48mL稀硫酸 | |
| C. | 用pH试纸测定HNO3溶液的pH=3.7 | |
| D. | 用托盘天平称取11.7gNaCl |
7.甲乙两份铝屑,分别与同浓度的盐酸和NaOH溶液反应,产生的氢气的体积比为1:2(相同状况下),则甲乙反应中消耗酸、碱的物质的量之比为 ( )
| A. | 1:l | B. | 1:2 | C. | 3:2 | D. | 2:3 |
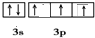 .
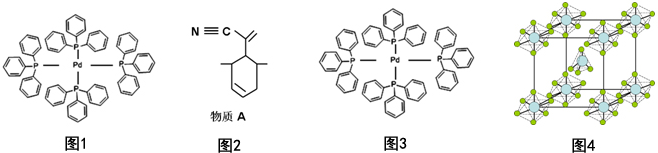
.
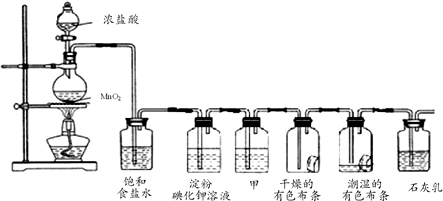
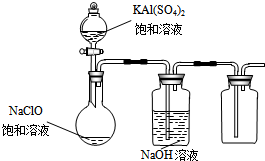 NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.