题目内容
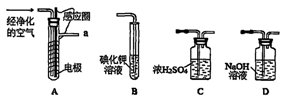
下列装置为中学化学实验常用的气体制备装置


A B C
(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置 。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置 。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置 。
(4)①某研究性小组查阅资料得知,漂白粉与硫酸溶液反应可制的氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4="2" CaSO4+2 Cl2+2H2O应选择装置 。
②为证明氯气具有氧化性将氯气分别通入到亚硫酸钠溶液和氯化亚铁溶液中,设计实验证明亚硫酸钠已经被氧化 。
写出氯气和氯化亚铁溶液反应的离子方程式: 。
③请写出氯气尾气处理的离子方程式 。
(1)A(2)C(3)A (4)① A ②取洗气瓶中C中的溶液少许,加入BaCl2溶液,再加入稀盐酸,若产生白色沉淀,则证明Na2SO3已被氧化;Fe2++ Cl2=2 Fe3++2 Cl- ③Cl2+2OH-=Cl-+ClO-+ 2H2O
解析试题分析:(1)若用NaHCO3和稀盐酸制取二氧化碳,应选择装置是固体和液体之间不需要加热的,因此符合条件的是装置A。
(2)若用NH4Cl和碱石灰制取NH3,应选择装置是固体和固体需要加热的,因此符合条件的是选项C。
(3)若用高锰酸钾和浓盐酸不加热制取Cl2,应选择装置是固体和液体之间不需要加热的,因此符合条件的是装置A。
(4)①根据反应的方程式可知Ca(ClO)2+CaCl2+2H2SO4=2CaSO4+2Cl2+2H2O,该反应是固体和液体之间不需要加热制备气体的,所以应该选择装置A。
②由于亚硫酸钡不溶于水,但能溶于水酸中。而硫酸钡不溶于水,也不溶于酸,所以证明亚硫酸钠已经被氧化实验方法是取洗气瓶中C中的溶液少许,加入BaCl2溶液,再加入稀盐酸,若产生白色沉淀,则证明Na2SO3已被氧化;氯气和氯化亚铁溶液反应的离子方程式是Fe2++ Cl2=2 Fe3++2 Cl-。
③氯气有毒,需要尾气处理,一般用氢氧化钠溶液吸收,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+ 2H2O。
考点:考查常用气体的发生装置;化学方程式、实验方案设计等
点评:本题主要是考查学生对于装置的选取方法的应用及方程式的书写等知识,可以很好的考查学生对于知识的理解和应用能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,有助于提升学生的学科素养,提高学生的应试能力和学习效率。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下:
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物 质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(1)滤渣的主要成分是 (写化学式)。
(2)调节反应A后溶液的pH范围应为 。选择的试剂最合适的是 (填序号)。
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是 。
(4)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。用相应的离子方程式表示:
① 沉淀只有CuCO3: ;
② 沉淀只有Cu(OH)2且放出气泡: 。
(5)碱式碳酸铜的组成可表示为:aCuCO3?bCu(OH)2?cH2O。要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称量样品的质量;②高温分解;③测出CO2的质量;④测出水蒸汽的质量;⑤称量CuO的质量。而乙同学认为除步骤②外,实验只需测定四个量中的三个即可,则合理的组合为 (填序号,写一组即可)。
采用下列装置和操作,能达到实验目的的是
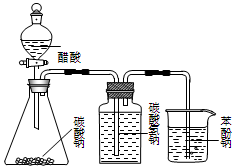


甲 乙 丙 丁
| A.甲装置:加热浓硫酸和乙醇(其体积为比3∶1)混合液,制取乙烯 |
| B.乙装置:比较醋酸、碳酸、苯酚三者的酸性强弱 |
| C.丙装置:向混有苯酚的苯中加入NaOH溶液,除去其中的苯酚 |
| D.丁装置:A中为乙醇、醋酸,B为饱和碳酸钠溶液,制取乙酸乙酯 |
下列实验操作不能达到其对应目的的是
| 序号 | 实验内容 | 实验目的 |
| A. | 向盛有10滴0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol/L Na2S溶液 | 证明AgCl沉淀能转化为溶解度更小的Ag2S沉淀 |
| B. | 向2 mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2mL己烷中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C. | 向Na2SiO3溶液中通入CO2 | 证明碳酸的酸性比硅酸强 |
| D. | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜并加热 | 验证淀粉已水解 |
下列各图示实验操作合理的是( ) 
| A.图1为证明非金属性强弱:S>C>Si |
| B.图2为制备少量氧气 |
| C.图3为配制一定物质的量浓度的硫酸溶液 |
| D.图4为制备并收集少量NO2气体 |
 2O3)。
2O3)。