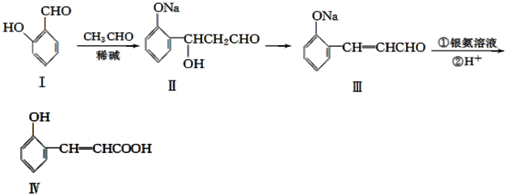
题目内容
W、X、Y、Z是原子序数依次增大的同一短周期主族元素,W、X是金属元素,且两者不相邻;Y、Z是非金属元素.
(1)W与Y可形成化合物W2Y,W2Y的电子式为 ,将等体积、等浓度的W的最高价氧化物对应的水化物和Y的氢化物混合,已知在该混合溶液中c(H2Y)>c(Y2-),则剩余各离子浓度由大到小的顺序为 .
(2)X的硝酸盐溶液显 (填“酸”、“碱”或“中”)性,原因是 (用离子方程式表示).
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 .
(4)W、X、Y、Z四种元素简单离子的离子半径由小到大的顺序是 .
(1)W与Y可形成化合物W2Y,W2Y的电子式为
(2)X的硝酸盐溶液显
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
(4)W、X、Y、Z四种元素简单离子的离子半径由小到大的顺序是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:W、X、Y、Z是原子序数依次增大的同一短周期主族元素,W、X是金属元素,且两者不相邻,只能处于第三周期,可推知W为Na、X为Al;Y、Z是非金属元素,(1)中W与Y可形成化合物W2Y,Y表现-2价,则Y为S,故Z为Cl,据此解答.
解答:
解:W、X、Y、Z是原子序数依次增大的同一短周期主族元素,W、X是金属元素,且两者不相邻,只能处于第三周期,可推知W为Na、X为Al;Y、Z是非金属元素,(1)中W与Y可形成化合物W2Y,Y表现-2价,则Y为S,故Z为Cl.
(1)W2Y为Na2S,其电子式为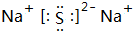 ,W的最高价氧化物对应的水化物为NaOH、Y的氢化物为H2S,二者溶液等体积、等浓度混合得到NaHS溶液,在该混合溶液中c(H2S)>c(S2-),说明HS-的水解程度大于其电离程度,溶液呈碱性,则剩余各离子浓度由大到小的顺序为:c(Na+)>c(HS-)>c(OH-)>c(H+),
,W的最高价氧化物对应的水化物为NaOH、Y的氢化物为H2S,二者溶液等体积、等浓度混合得到NaHS溶液,在该混合溶液中c(H2S)>c(S2-),说明HS-的水解程度大于其电离程度,溶液呈碱性,则剩余各离子浓度由大到小的顺序为:c(Na+)>c(HS-)>c(OH-)>c(H+),
故答案为: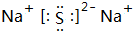 ;c(Na+)>c(HS-)>c(OH-)>c(H+);
;c(Na+)>c(HS-)>c(OH-)>c(H+);
(2)X的硝酸盐为Al(NO3)3,溶液中Al3+离子水解:Al3++3H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性,
故答案为:酸;Al3++3H2O?Al(OH)3+3H+;
(3)Y的低价氧化物为二氧化硫,通入氯气的水溶液中,发生反应的化学方程式为:Cl2+SO2+2H2O=H2SO4+2HCl,
故答案为:Cl2+SO2+2H2O=H2SO4+2HCl;
(4)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(Al3+)<r(Na+)<r(Cl-)<r(S2-),
故答案为:r(Al3+)<r(Na+)<r(Cl-)<r(S2-).
(1)W2Y为Na2S,其电子式为
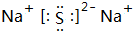 ,W的最高价氧化物对应的水化物为NaOH、Y的氢化物为H2S,二者溶液等体积、等浓度混合得到NaHS溶液,在该混合溶液中c(H2S)>c(S2-),说明HS-的水解程度大于其电离程度,溶液呈碱性,则剩余各离子浓度由大到小的顺序为:c(Na+)>c(HS-)>c(OH-)>c(H+),
,W的最高价氧化物对应的水化物为NaOH、Y的氢化物为H2S,二者溶液等体积、等浓度混合得到NaHS溶液,在该混合溶液中c(H2S)>c(S2-),说明HS-的水解程度大于其电离程度,溶液呈碱性,则剩余各离子浓度由大到小的顺序为:c(Na+)>c(HS-)>c(OH-)>c(H+),故答案为:
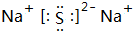 ;c(Na+)>c(HS-)>c(OH-)>c(H+);
;c(Na+)>c(HS-)>c(OH-)>c(H+);(2)X的硝酸盐为Al(NO3)3,溶液中Al3+离子水解:Al3++3H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性,
故答案为:酸;Al3++3H2O?Al(OH)3+3H+;
(3)Y的低价氧化物为二氧化硫,通入氯气的水溶液中,发生反应的化学方程式为:Cl2+SO2+2H2O=H2SO4+2HCl,
故答案为:Cl2+SO2+2H2O=H2SO4+2HCl;
(4)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:r(Al3+)<r(Na+)<r(Cl-)<r(S2-),
故答案为:r(Al3+)<r(Na+)<r(Cl-)<r(S2-).
点评:本题考查结构性质位置关系应用,关键是结合位置关系、化合物结构推断元素,(1)中离子浓度比较,关键是判断反应后溶液中溶质,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学用语表达正确的是( )
A、Cl-的结构示意图: | ||
| B、乙酸的结构式:C2H4O2 | ||
| C、氯化氢分子的电子式:H+[:Cl:]- | ||
D、质量数为137的钡原子:
|
下列有关含氧酸的说法中正确的是( )
| A、元素的非金属性越强,其含氧酸的酸性就越强 |
| B、含氧酸中有多少个H原子,就属于几元酸 |
| C、同一元素的不同含氧酸,羟基氧越多,该酸的酸性越强 |
| D、同一元素的不同含氧酸中,该元素的化合价越高,其含氧酸的酸性越强 |
下列图示与对应叙述相符的是( )
A、 反应达到平衡后,升高温度,平衡正向移动 |
B、 表示镁条放入盐酸中生成氢气速率随时间的变化 |
C、 表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化 |
D、 表示向氨水中通入HCl气体,溶液的导电能力变化 表示向氨水中通入HCl气体,溶液的导电能力变化 |
下列反应能够使碳链简短的有( )
①烯烃被KMnO4(H+,aq)氧化 ②乙苯被KMnO4(H+,aq)氧化
③重油裂化为汽油 ④CH3COONa跟碱石灰共热 ⑤炔烃与溴水反应.
①烯烃被KMnO4(H+,aq)氧化 ②乙苯被KMnO4(H+,aq)氧化
③重油裂化为汽油 ④CH3COONa跟碱石灰共热 ⑤炔烃与溴水反应.
| A、①②③④⑤ | B、②③④⑤ |
| C、①②④⑤ | D、①②③④ |
 A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为9.又知B、D、E分别与A、C两元素形成的三种化合物X、Y、Z之间能相互发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,1mol M中含有42mol电子.回答下列问题:
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大.A、D同主族;B、D、E三种元素原子的最外层电子数之和为9.又知B、D、E分别与A、C两元素形成的三种化合物X、Y、Z之间能相互发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M,1mol M中含有42mol电子.回答下列问题: