题目内容
9.下列说法不正确的是( )| A. | 淀粉、纤维素水解的最终产物都是葡萄糖 | |
| B. | 误服可溶性重金属盐,立即服用大量牛奶可以解毒 | |
| C. | 用灼烧的方法可鉴别毛织物和棉织物 | |
| D. | 温度越高,酶对某些化学反应的催化效率越高 |
分析 A.淀粉、纤维素为多糖,可水解生成葡萄糖;
B.重金属盐可使蛋白质变性;
C.毛织物含有蛋白质;
D.温度过高,可使蛋白质变性.
解答 解:A.淀粉、纤维素为多糖,水解的最终产物都为葡萄糖,故A正确;
B.重金属盐可使蛋白质变性,则误服可溶性重金属盐,立即服用大量牛奶可以解毒,故B正确;
C.毛织物含有蛋白质,灼烧时具有烧焦的羽毛气味,故C正确;
D.温度过高,可使蛋白质变性,温度越高,酶失去活性,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、官能团与性质、营养物质的性质等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
11.下列有关物质性质或应用的说法中不正确的是( )
| A. | 自来水厂可用明矾作净水剂 | |
| B. | 二氧化硅既能与氢氟酸反应又能与氢氧化钠溶液反应,所以二氧化硅是两性氧化物 | |
| C. | 丁达尔效应是区分胶体与溶液的一种常用方法 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
12.下列反应中能用于检验尿液中是否含有葡萄糖的是( )
| A. | 加金属钠看是否有氢气放出 | |
| B. | 与新制的氢氧化铜悬浊液混合后共热,观察是否有红色沉淀 | |
| C. | 与醋酸和浓H2SO4共热,观察是否有果香味物质生成 | |
| D. | 加入酸性KMnO4溶液,看溶液是否褪色 |
17.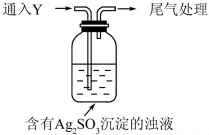 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为2Ag++O2+2SO32-=Ag2SO4↓+SO42-.
该同学设计实验确认了A、B、C中的白色沉淀不是Ag2SO4,实验方法是:取B、C中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将C中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是证明X不是Ag2O.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O$\stackrel{H+}{→}$2Ag+H2SO4.
 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为2Ag++O2+2SO32-=Ag2SO4↓+SO42-.
该同学设计实验确认了A、B、C中的白色沉淀不是Ag2SO4,实验方法是:取B、C中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将C中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是证明X不是Ag2O.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O$\stackrel{H+}{→}$2Ag+H2SO4.
4.利用碳酸钠晶体(Na2CO3•10H2O)来配制1.0mol•L-1 Na2CO3溶液500mL,假如其他操作均准确无误,下列情况会引起所配溶液浓度偏高的是( )
| A. | 称取碳酸钠晶体53.0g | |
| B. | 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 | |
| C. | 定容时,俯视观察刻度线 | |
| D. | 定容后,将容量瓶反复倒转、摇匀、静置时发现液面低于刻度线,于是又加入少量水至刻度线 |
18.下列文字表述与反应方程式对应且正确的是( )
| A. | 实验室用溴水和苯在催化剂作用下制溴苯: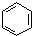 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$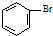 +HBr +HBr | |
| B. | 乙酸乙酯和H${\;}_{2}^{18}$O发生酸性水解反应:CH3COOC2H5+H-18OH $?_{△}^{酸}$CH3CO18OH+C2H5OH | |
| C. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2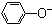 +CO2+H2O→ +CO2+H2O→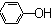 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ | |
| D. | 甲醛溶液与足量的银氨溶液共热:HCHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$HCOONH4+2Ag↓+3NH3+H2O |
19.下列说法正确的是( )
| A. | Fe和Mg与0.1 mol•L-1的盐酸反应,反应速率相同 | |
| B. | 0.1 mol•L-1的盐酸与H2SO4分别与大小、形状相同的大理石反应,反应速率相同 | |
| C. | 催化剂能降低分予活化时所需能量,使单位体积内活化分子百分数大大增加 | |
| D. | 100Ml 2mol•L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变 |
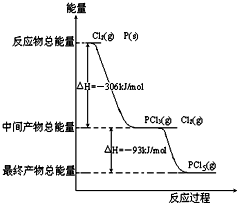 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).