题目内容
下列分子中的中心原子杂化轨道的类型相同的是( )
| A、SO3与SO2 |
| B、BF3与NH3 |
| C、BeCl2与SCl2 |
| D、H2O与SO2 |
考点:原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:A、B、C、D物质属于ABm,ABm型杂化类型的判断:
公式:电子对数n=
(中心原子的价电子数+配位原子的成键电子数±电荷数)
注意:①当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”.
②当配位原子为氧原子或硫原子时,成键电子数为零.
公式:电子对数n=
| 1 |
| 2 |
注意:①当上述公式中电荷数为正值时取“-”,电荷数为负值时取“+”.
②当配位原子为氧原子或硫原子时,成键电子数为零.
解答:
解:A、SO3中S原子杂化轨道数为
(6+0)=3,采取 sp2杂化方式,SO2中S原子杂化轨道数为
(6+0)=3,采取 sp2杂化方式,故A正确.
B、BF3中B原子杂化轨道数为
(3+3)=3,采取 sp2杂化方式,NH3中N原子杂化轨道数为
(5+3)=4,采取 sp3杂化方式,二者杂化方式不同,故B错误;
C、BeCl2中Be原子杂化轨道数为
(2+2)=2,采取 sp杂化方式,SCl2中S原子杂化轨道数为
(6+2)=4,采取 sp3杂化方式,二者杂化方式不同,故C错误;
D、H2O中O原子杂化轨道数为
(6+2)=4,采取sp3杂化方式,SO2中S原子杂化轨道数为
(6+0)=3,采取sp2杂化方式,中心原子杂化轨道的类型不同,故D错误.
故选:A.
| 1 |
| 2 |
| 1 |
| 2 |
B、BF3中B原子杂化轨道数为
| 1 |
| 2 |
| 1 |
| 2 |
C、BeCl2中Be原子杂化轨道数为
| 1 |
| 2 |
| 1 |
| 2 |
D、H2O中O原子杂化轨道数为
| 1 |
| 2 |
| 1 |
| 2 |
故选:A.
点评:考查杂化轨道理论,难度中等,判断中心原子的杂化轨道数是关键.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
 乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( )
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中正确的是( ) ①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1mol NaOH.
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol.
| A、①②③ | B、①②⑤ |
| C、①②⑤⑥ | D、①②④⑤⑥ |
 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A、△H>0 a+b>c |
| B、△H<0 a+b<c |
| C、△H<0 a+b>c |
| D、△H>0 a+b<c |
关于溶液中所含离子的检验,下列判断正确的是( )
| A、向溶液中加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不溶解,则原溶液中一定含有SO42- |
| B、向溶液中滴加浓NaOH溶液并加热,产生的气体能使湿润的蓝色石蕊试液变红,则原溶液中一定含有NH4+ |
| C、向溶液中加入几滴KSCN溶液,溶液不显红色,再向溶液中加几滴新制氯水,溶液变为血红色,该溶液中一定含有Fe2+ |
| D、向溶液中滴加稀盐酸产生无色无味气体,产生的气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- |
下列做法对人体无害的是( )
| A、工业酒精(含甲醇)兑水配制白酒饮用 |
| B、在食盐中加入碘酸钾(KIO3)以消除碘缺乏病 |
| C、制作腊肉常入亚硝酸盐作增色剂,宜长期食用 |
| D、用工业石蜡给瓜子美容 |

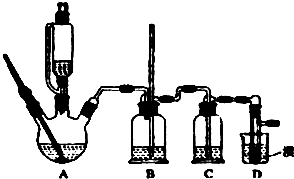 实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH