题目内容
11. 如图所示为CH4燃料电池的装置(A、B为多孔碳棒):
如图所示为CH4燃料电池的装置(A、B为多孔碳棒):(1)B(填A或B)处电极入口通甲烷,其电极反应式为CH4-8e-+10OH-═CO32-+7H2O
(2)当消耗甲烷的体积为11.2L(标准状况下)时,消耗KOH的质量为56g.
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、硫酸构成.该电池工作时,正极的电极反应为PbO2+4H++2e-+SO42-=PbSO4+2H2O.
(4)500mL KNO3和Cu(N03)2的混合溶液中c(NO3-)=6.0mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL.原混合溶液中c(K+)为2mol•L-1.
分析 (1)通燃料的一极是负极发生氧化反应,失电子,电子流出,所以B是处电极入口通甲烷,发生氧化反应,电极反应式为:CH4-8e-+10OH-═CO32-+7H2O;
(2)根据甲烷和转移电子、氢氧化钾之间的关系式计算;
(3)铅蓄电池中正极是二氧化铅得到电子生成硫酸铅;
(4)石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),
则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
阳极发生4OH--4e-═O2↑+2H2O,
n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,结合电荷守恒来计算.
解答 解:(1)通燃料的一极是负极发生氧化反应,失电子,电子流出,所以B是处电极入口通甲烷,发生氧化反应,电极反应式为:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:B;CH4-8e-+10OH-═CO32-+7H2O;
(2)根据CH4+2O2+2OH-═CO32-+3H2O知,消耗KOH的物质的量为甲烷物质的量的2倍,所以消耗氢氧化钾的物质的质量是$\frac{11.2}{22.4}$×2×56=56g,故答案为:56;
(3)铅蓄电池中正极是二氧化铅得到电子生成硫酸铅,电极反应为:PbO2+4H++2e-+SO42-=PbSO4+2H2O,
故答案为:PbO2+4H++2e-+SO42-=PbSO4+2H2O;
(4)石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,
阳极发生4OH--4e-═O2↑+2H2O,
4mol 1mol
阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
1mol 2mol 1mol 2mol 1mol
则c(Cu2+)=$\frac{1mol}{0.5L}$=2mol/L,由电荷守恒可知,原混合溶液中c(K+)=6mol/L-2mol/L×2=2mol/L,故答案为:2.
点评 本题考查了原电池和电解池原理,明确发生的电极反应及电荷守恒是解答本题的关键,题目难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案| A. | 塑料 | B. | 淀粉 | C. | 油脂 | D. | 蛋白质 |
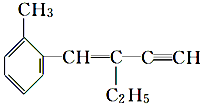
| A. | 该有机物结构简式为C13H14 | |
| B. | 该有机物属于苯的同系物 | |
| C. | 该有机物分子中至少有6个碳原子共平面 | |
| D. | 该有机物能与溴水发生加成反应且1mol该有机物最多能加成3mol的Br2 |
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为V2O5+2H+=2VO2++H2O,同时V2O4转化成VO2+.“废渣1”的主要成分是SiO2.
(2)“氧化”中欲使3mol的VO2+变为VO2+,则需要氧化剂KClO3至少为0.5mol.
| A. | 燃烧煤炭供热会加剧“温室效应“ | |
| B. | 将废旧电池深埋处理,可有效防止电池中的重金属污染 | |
| C. | 预防H7N9流感病毒的措施之一是高温消毒餐具等生活日用品 | |
| D. | 开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济” |
| A. | Ba(OH)2 +H2SO4 ═BaSO4↓+2H2O | B. | BaCO3 +2HNO3═Ba(NO3)2 +CO2↑+H2O | ||
| C. | NaOH+HCl═NaCl+H2O | D. | Mg(OH)2 +2HCl═Mg Cl2+2H2O |
 .
.
 .
.