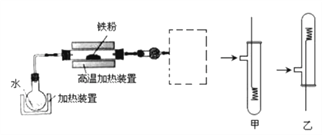
题目内容
【题目】以下是氮循环的一部分:

(1)通常状况下,NO2的颜色是__________;
(2)反应①的化学方程式是________________________________;
(3)NO2易溶于水,并和水发生化学反应。该反应中,氧化剂是_________;
(4)化合物A的化学式是_______________;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:
2NO + 2CO = 2CO2 + N2。当生成2mol N2时,被还原的NO为___mol。
【答案】红棕色 N2+O2![]() 2NO NO2 HNO3 4
2NO NO2 HNO3 4
【解析】
(1)NO2的颜色是红棕色。
(2)反应①就是N2和O2在放电条件的反应,化学方程式是N2+O2![]() 2NO。
2NO。
(3)NO2易溶于水,发生化学反应是3NO2+H2O![]() HNO3+NO。该反应中NO2的氮元素化合价既有降低又有升高,NO2既是氧化剂有事还原剂。
HNO3+NO。该反应中NO2的氮元素化合价既有降低又有升高,NO2既是氧化剂有事还原剂。
(4)从上述方程式可以知道A的化学式是HNO3。
(5)从 2NO + 2CO = 2CO2 + N2看出NO 和N2的比为2︰1,则生成2mol N2时被还原的NO为4mol。

 阅读快车系列答案
阅读快车系列答案【题目】甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/(kJ/mol) | 351.5 | 463 | 393 | 293 |
则该反应的ΔH=________kJ/mol。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①下列说法不能判断该反应达到化学平衡状态的是________。
A.体系中气体的密度保持不变
B.CO的消耗速率与CH3OH的消耗速率相等
C.体系中CO的转化率和H2的转化率相等
D.体系中CH3OH的体积分数保持不变
②平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
③某同学认为上图中Y轴表示温度,你认为他判断的理由是______________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,同时生成I2,写出发生的化学反应方程式__________________。
(4)HI的制备:将0.8molI2(g)和1.2molH2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)![]() 2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g)并达到平衡。HI的体积分数随时间的变化如表格所示:
时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7/span> |
HI体积分数 | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
①该反应的平衡常数K=_____________。
②反应达到平衡后,在7min时将容器体积压缩为原来的一半,请在图中画出c(HI)随时间变化的曲线_______________。