题目内容
【题目】H、N、O、S、Ni、As为元素周期表中1~4周期元素。请回答下列问题:
(1)上述元素中第一电离能最大的元素符号是___________,电负性最大的元素的原子其价电子轨道表示式为___________。
(2)CH3NO2中C和N的原子轨道杂化方式分别为___________、___________。
(3)SO32-其空间构型为___________。写出一种与该酸根等电子体的微粒___________。
(4)NH3极易溶于水其原因除二者都为极性分子外,另一个重要原因是___________。
(5)Ni与As形成的一种化合物,其晶体如图所示,属六方晶系。

①该晶体的化学式为___________,As原子的配位数为___________。
②已知晶胞参数a=360.2pm,c=500.9pm,此晶体的密度为___________g·cm-3。(写出计算式,NA为阿伏加德罗常数的值)
【答案】N ![]() sp3 sp2 三角锥形 AsO33-、ClO3- 、PCl3 NH3分子与水分子间形成氢键 NiAs 6
sp3 sp2 三角锥形 AsO33-、ClO3- 、PCl3 NH3分子与水分子间形成氢键 NiAs 6 ![]()
【解析】
(1)因为N的价电子排布式为2s22p3,处于半充满状态,第一电离能最大的是N;O原子电负性最大;
(2)分析C、N成键情况,结合VSEPR模型判断;
(3)结合VSEPR模型判断;结合等电子体解答;
(4)NH3分子与水分子间形成氢键,增大氨的溶解性。
(5)①根据均摊法求解;②根据ρ=m/V计算。
(1)H、N、O、S、Ni、As中,因为N的价电子排布式为2s22p3,处于半充满状态,第一电离能最大的是N;O原子电负性最大,其价电子轨道表示式为![]() 。
。
(2)CH3NO2中C原子最外层的4个电子全部参与成键,VSEPR模型为正四面体,所以采取sp3杂化;N原子最外层的5个电子,形成3个σ键,还有1个π键,VSEPR模型为平面三角形,所以采取sp2杂化。C和N的原子轨道杂化方式分别为sp3 、sp2。
(3)SO32-中S上的孤电子对数为(6+2-2×3)/2=1,σ键数为3,价层电子对数=1+3=4,采用sp3杂化,其空间构型为三角锥形。与SO32-原子数相同,价电子总数相同的粒子可能为:AsO33-、ClO3- 、PCl3等之一。
(4)NH3极易溶于水其原因,除二者都为极性分子外,另一个重要原因是NH3分子与水分子间形成氢键。
(5)Ni与As形成的一种化合物,其晶体如图所示,属六方晶系。
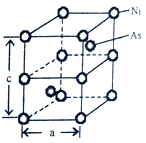
①Ni:8×1/8+4×1/4=2,As:2,化学式为NiAs;As原子的配位数为6;
②已知晶胞参数a=360.2pm,c=500.9pm,V=![]() ,此晶体的密度为ρ=m/V=
,此晶体的密度为ρ=m/V=![]() g·cm-3。
g·cm-3。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案