题目内容
7.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置己略去,粗黑线表示乳胶管.请填写下列空白: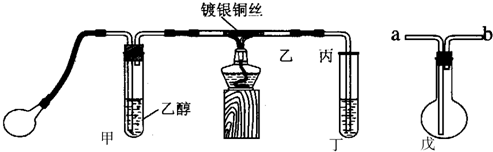
(1)甲装置常常浸在温度为70~80℃的水浴中,目的是适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流.
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态.若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束.乙醇的催化氧化反应是放热反应(填“放热”或“吸热”),该反应的化学方程式为2CH3CH2OH+O2$→_{加热}^{铜或银}$2CH3CHO+H2O.
(3)在实验过程中控制鼓气的速度很重要:
①控制鼓气速度的方法是控制甲中单位时间内气泡数,
②若鼓气速度过快反应会停止的原因带走过多热量,难以保证反应所需温度.
分析 (1)加热时采用水浴加热可以让乙醇平稳气化成乙醇蒸气;
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态.若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应放出热量维持反应继续继续,乙醇催化氧化生成乙醛和水;:2CH3CH2OH+O2$→_{加热}^{铜或银}$2CH3CHO+H2O;
(3)①根据甲中的现象进行解答;
②若鼓气速度过快,带走过多热量,难以保证反应所需温度;
解答 解:(1)甲装置常常浸在温度为70~80的水浴中,水浴能使容器受热均匀,能使甲中乙醇平稳气化成乙醇蒸气,
故答案为:适当加快生成乙醇蒸汽的速率,获得平稳的乙醇气流;
(2)实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态.若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应放出热量维持反应继续继续,反应为放热反应,乙醇催化氧化生成乙醛和水;化学方程式:2CH3CH2OH+O2$→_{加热}^{铜或银}$2CH3CHO+H2O;
故答案为:放热; 2CH3CH2OH+O2$→_{加热}^{铜或银}$2CH3CHO+H2O;
(3)①鼓气的速度越快,甲中单位时间内冒出的气体就越多,反之,越少,
故答案为:控制甲中单位时间内气泡数;
若鼓气速度过快则会因气流过大,带走过多热量,难以保证反应所需温度,导致反应停止,
故答案为:带走过多热量,难以保证反应所需温度;
点评 本题考查了乙醇的催化氧化实验,掌握乙醇的化学性质以及乙醇的催化氧化实验操作时解答的关键,题目难度中等.

练习册系列答案
相关题目
19.下列叙述正确的是( )
| A. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| B. | 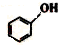 和 和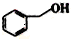 分子组成相差一个-CH2-,因此是同系物 分子组成相差一个-CH2-,因此是同系物 | |
| C. | 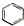 和 和 均是芳香烃, 均是芳香烃,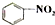 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| D. | 分子式为C3H6有机物最多存在4个C-C单键,与C5H12的碳碳单键数相同 |
20.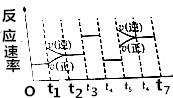 反应3A(g)?2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变,下列判断正确的是( )
反应3A(g)?2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变,下列判断正确的是( )
 反应3A(g)?2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变,下列判断正确的是( )
反应3A(g)?2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如图所示,在t1、t3、t4、t5时刻都只有一种因素发生改变,下列判断正确的是( )| A. | t6~t7阶段,C的百分含量最大 | |
| B. | t2~t3阶段,A的转化率最小 | |
| C. | t3时刻,改变因素一定是使用了催化剂 | |
| D. | t5时刻,改变因素一定是升高了温度 |
15. 如图是两种有机分子的比例模型(
如图是两种有机分子的比例模型( 表示碳原子,
表示碳原子, 表示氢原子,
表示氢原子, 表示氧原子,下列有关叙述不正确的是( )
表示氧原子,下列有关叙述不正确的是( )
 如图是两种有机分子的比例模型(
如图是两种有机分子的比例模型( 表示碳原子,
表示碳原子, 表示氢原子,
表示氢原子, 表示氧原子,下列有关叙述不正确的是( )
表示氧原子,下列有关叙述不正确的是( )| A. | 甲、乙都含有羧基 | |
| B. | 甲、乙两物质都能和活泼金属钠反应放出H2 | |
| C. | 甲可以在一定条件下和乙反应生成酯 | |
| D. | 甲、乙两物质的分子式分别为C3H6O3、C2H602 |
12.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 2.3g金属钠在一定条件下生成Na2O和Na2O2的混合物时,钠失去的电子数目为0.1NA | |
| B. | 22.4L氧气中所含的分子数目为NA | |
| C. | 1mol/L Na2CO3溶液中含有Na+离子数目是NA | |
| D. | 17g氨气中所含氢原子数目为4NA |
16.要除去下表所列有机物中的杂质(括号内为杂质),从(1)中选择适宜的试剂,从(2)中选择分离提纯的方法,用序号填入表中.
(1)试剂:a.溴水 b.氢氧化钠溶液 c.碳酸钠溶液 d.生石灰 e.酸性高锰酸钾溶液
(2)方法:A.过滤 B.分液 C.蒸馏 D.洗气
(1)试剂:a.溴水 b.氢氧化钠溶液 c.碳酸钠溶液 d.生石灰 e.酸性高锰酸钾溶液
(2)方法:A.过滤 B.分液 C.蒸馏 D.洗气
| 要提纯的物质 (杂质) | 乙烷 (乙烯) | 乙酸乙酯 (乙酸) | 乙醇 (水) | 溴苯 (溴) |
| 选用试剂 | ||||
| 分离方法 |
17.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的CuO粉末 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | CO高温下还原Fe2O3 | D. | 将锌粒投入Cu(NO3)2溶液 |