题目内容
 A、B、C、D、E五中物质都含有同一种元素,它们按图所示的关系相互转化,已知A为单质,C为一种淡黄色的固体,
A、B、C、D、E五中物质都含有同一种元素,它们按图所示的关系相互转化,已知A为单质,C为一种淡黄色的固体,(1)写出A~E的化学式
A
C
(2)写出下列转化关系的化学方程式,
其中属于氧化还原反应的请标出电子转移的方向和数目
①A→B
②A→C
③A→D
④C→D
⑤C→E
⑥D→E
考点:无机物的推断
专题:推断题
分析:A为单质,C为一种淡黄色的固体,A再空气中燃烧得到C,则C为Na2O2,A为Na,由转化关系,可推知B为Na2O,D为NaOH,E为Na2CO3,以此来解答.
解答:
解:(1)A为单质,C为一种淡黄色的固体,A再空气中燃烧得到C,则C为Na2O2,A为Na,由转化关系,可推知B为Na2O,D为NaOH,E为Na2CO3,
故答案为:Na;Na2O;Na2O2;NaOH;Na2CO3;
(2)①A→B的反应为:4Na+O2=2Na2O,属于氧化还原反应,标出电子转移数目与方向为: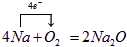 ,
,
②A→C的反应为:2Na+O2=Na2O2,属于氧化还原反应,标出电子转移数目与方向为: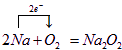 ,
,
③A→D的反应为:2Na+2H2O=2NaOH+H2↑,属于氧化还原反应,标出电子转移数目与方向为: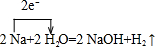 ,
,
④C→D的反应为:2Na2O2+2H2O=4NaOH+O2↑,属于氧化还原反应,标出电子转移数目与方向为: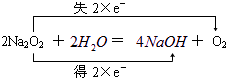 ,
,
⑤C→E的反应为:2Na2O2+2CO2=2Na2CO3+O2↑,属于氧化还原反应,标出电子转移数目与方向为: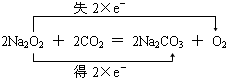 ,
,
⑥D→E的反应为:4NaOH+CO2=Na2CO3+2Na2O,属于非氧化还原反应,
故答案为: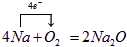 ;
;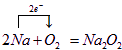 ;
;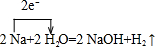 ;
;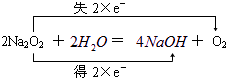 ;
;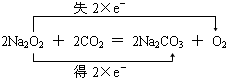 ;4NaOH+CO2=Na2CO3+2Na2O.
;4NaOH+CO2=Na2CO3+2Na2O.
故答案为:Na;Na2O;Na2O2;NaOH;Na2CO3;
(2)①A→B的反应为:4Na+O2=2Na2O,属于氧化还原反应,标出电子转移数目与方向为:
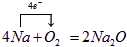 ,
,②A→C的反应为:2Na+O2=Na2O2,属于氧化还原反应,标出电子转移数目与方向为:
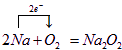 ,
,③A→D的反应为:2Na+2H2O=2NaOH+H2↑,属于氧化还原反应,标出电子转移数目与方向为:
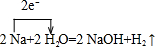 ,
,④C→D的反应为:2Na2O2+2H2O=4NaOH+O2↑,属于氧化还原反应,标出电子转移数目与方向为:
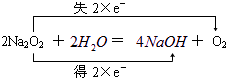 ,
,⑤C→E的反应为:2Na2O2+2CO2=2Na2CO3+O2↑,属于氧化还原反应,标出电子转移数目与方向为:
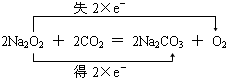 ,
,⑥D→E的反应为:4NaOH+CO2=Na2CO3+2Na2O,属于非氧化还原反应,
故答案为:
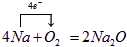 ;
;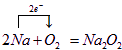 ;
;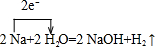 ;
;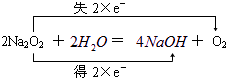 ;
;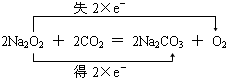 ;4NaOH+CO2=Na2CO3+2Na2O.
;4NaOH+CO2=Na2CO3+2Na2O.
点评:本题考查无机物的推断,C为解答本题的突破口,侧重钠及其化合物的转化的考查及电子转移表示,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列物质分类正确的是( )
| A、碘酒(单质) |
| B、空气(混合物) |
| C、葡萄糖(酸) |
| D、硫酸(氧化物) |
1909年丹麦科学家Sorensen用公式pH=-lgc(H+)引入pH,1999年荷兰科学家HenK Van Lubeck提出酸度(AG)的概念,以更好地表示溶液的酸碱性.酸度(AG)的定义为 AG=lg[
]. 下列有关叙述中错误的是( )
| c(H+) |
| c(OH-) |
| A、常温时,中性溶液的pH=7,AG=0 |
| B、酸性溶液的AG>0,AG越大,溶液的pH越小 |
| C、碱性溶液的AG>0,AG越大,溶液的pH越大 |
| D、常温下,0.1 mol/LNaOH溶液,AG=-12,pH=13 |
下列各组离子或分子在指定条件下一定能大量共存的是( )
| A、能使紫色石蕊试液变红的溶液中:Na+、K+、AlO2-、CO32- |
| B、氢氧化铁胶体:H+、K+、S2-、Br- |
| C、高锰酸钾溶液:H+、K+、SO42-、葡萄糖 |
| D、室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- |

 如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答: