题目内容
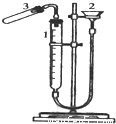
利用右图装置测定金属镁的相对原子质量.请根据要求回答有关问题:实验方法如下:
(1)加药品前要检查该装置的气密性,较简便单的方法是:______.
(2)气密性检验后,按以下步骤进行实验,请回答有关问题:
①装硫酸.取下试管,加入______mol/L的H2SO4且体积应大于______ml.
②放置镁条.为保证产生的氢气不泄漏,应将镁条放置在______.
③记下量气管起始读数V1. ④将试管竖直,使镁条滑到试管中与酸反应;
⑤记下镁条反应完后的量气管读数V2.如何读数才能减少误差______.
(3)经测定镁与酸反应产生H2的体积为V L(已折算成标准状况),则镁的相对原子质量的表达式为(相对原子质量用M表示):.
(4)如果测得的值比实际值偏大,请你分析产生误差偏大的可能原因(假设在测得外界温度、压强以及在换算、计算过程中都没有错误.至少写2条)①②.
【答案】分析:(1)根据大气压强原理来检验装置的气密性情况;
(2)根据实验原理是:金属镁可以和稀硫酸发生反应生成氢气,通过测定氢气的体积,来获得金属镁的物质的量,根据M= 可以获得金属镁的原子量;
可以获得金属镁的原子量;
(3)根据M= =
= 来计算;
来计算;
(4)根据计算式:M= =
= 来分析结果偏大的可能原因.
来分析结果偏大的可能原因.
解答:解:(1)根据气压原理,检验装置气密性的方法是:向漏斗中加入一定量的水,若量气管内水面低于漏斗中的水面,且数分钟(或一段时间)保持不变,则气密性良好,
故答案为:向漏斗中加入一定量的水,若量气管内水面低于漏斗中的水面,且数分钟(或一段时间)保持不变,则气密性良好;
(2)①金属镁可以和稀硫酸发生反应生成氢气,和浓硫酸不会产生氢气,根据金属镁的质量0.48克,即0.02mol,需要硫酸的物质的量为0.02mol,要保证金属镁全部反应,需要硫酸至少0.02mol,所以硫酸的体积至少为10mL,
故答案为:2.0 mol?L-1;10ml;
②为保证产生的氢气不泄漏,应该将镁带放在试管口的上部,不与硫酸接触,故答案为:试管口的上部,不与硫酸接触;
⑤待试管冷却至室温,调节漏斗高度,使两端管内液面保持相平,此时测得的氢气的体积才是常温常压下的氢气的体积,故答案为:待试管冷却至室温,调节漏斗高度,使两端管内液面保持相平;
(3)根据公式:M= =
= 得:M(Mg)=
得:M(Mg)= ;故答案为:
;故答案为: ;
;
(4)根据公式:M= =
= ,得当①镁表面部分被氧化时,即m偏大,会导致M偏高;②镁中含有不与酸反应的杂质(答“有杂质”也对),也会导致M偏大;③量气时,漏斗中水的液面高于量气管中水的液面,此时实际体积V偏小,所以M偏大,
,得当①镁表面部分被氧化时,即m偏大,会导致M偏高;②镁中含有不与酸反应的杂质(答“有杂质”也对),也会导致M偏大;③量气时,漏斗中水的液面高于量气管中水的液面,此时实际体积V偏小,所以M偏大,
故答案为:①镁表面部分被氧化②镁中含有不与酸反应的杂质;③量气时,漏斗中水的液面高于量气管中水的液面(任选两条).
点评:本题是一道关于实验探究和数据处理知识的考题,考查学生分析和解决问题的能力,难度较大.
(2)根据实验原理是:金属镁可以和稀硫酸发生反应生成氢气,通过测定氢气的体积,来获得金属镁的物质的量,根据M=
 可以获得金属镁的原子量;
可以获得金属镁的原子量;(3)根据M=
 =
= 来计算;
来计算;(4)根据计算式:M=
 =
= 来分析结果偏大的可能原因.
来分析结果偏大的可能原因.解答:解:(1)根据气压原理,检验装置气密性的方法是:向漏斗中加入一定量的水,若量气管内水面低于漏斗中的水面,且数分钟(或一段时间)保持不变,则气密性良好,
故答案为:向漏斗中加入一定量的水,若量气管内水面低于漏斗中的水面,且数分钟(或一段时间)保持不变,则气密性良好;
(2)①金属镁可以和稀硫酸发生反应生成氢气,和浓硫酸不会产生氢气,根据金属镁的质量0.48克,即0.02mol,需要硫酸的物质的量为0.02mol,要保证金属镁全部反应,需要硫酸至少0.02mol,所以硫酸的体积至少为10mL,
故答案为:2.0 mol?L-1;10ml;
②为保证产生的氢气不泄漏,应该将镁带放在试管口的上部,不与硫酸接触,故答案为:试管口的上部,不与硫酸接触;
⑤待试管冷却至室温,调节漏斗高度,使两端管内液面保持相平,此时测得的氢气的体积才是常温常压下的氢气的体积,故答案为:待试管冷却至室温,调节漏斗高度,使两端管内液面保持相平;
(3)根据公式:M=
 =
= 得:M(Mg)=
得:M(Mg)= ;故答案为:
;故答案为: ;
;(4)根据公式:M=
 =
= ,得当①镁表面部分被氧化时,即m偏大,会导致M偏高;②镁中含有不与酸反应的杂质(答“有杂质”也对),也会导致M偏大;③量气时,漏斗中水的液面高于量气管中水的液面,此时实际体积V偏小,所以M偏大,
,得当①镁表面部分被氧化时,即m偏大,会导致M偏高;②镁中含有不与酸反应的杂质(答“有杂质”也对),也会导致M偏大;③量气时,漏斗中水的液面高于量气管中水的液面,此时实际体积V偏小,所以M偏大,故答案为:①镁表面部分被氧化②镁中含有不与酸反应的杂质;③量气时,漏斗中水的液面高于量气管中水的液面(任选两条).
点评:本题是一道关于实验探究和数据处理知识的考题,考查学生分析和解决问题的能力,难度较大.

练习册系列答案
相关题目
 利用右图装置测定金属镁的相对原子质量.请根据要求回答有关问题:(所提供试剂有:0.48克镁带、18.4mol?L-1的H2SO4、2.0mol?L-1的H2SO4)
利用右图装置测定金属镁的相对原子质量.请根据要求回答有关问题:(所提供试剂有:0.48克镁带、18.4mol?L-1的H2SO4、2.0mol?L-1的H2SO4) 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.