题目内容
制备氮化镁的装置示意图如图所示:

回答下列问题:
(1)检查装置气密性的方法是______,a的名称是______,b的名称是______;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式______;
(3)C的作用是______,D的作用是______,是否可以把C和D的位置对调并说明理由______;
(4)写出E中发生反应的化学方程式______;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象______.
解:(1)利用装置内气体热胀冷缩检验装置的气密性,检查装置气密性的方法是:微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好;
由图中仪器结构可知,a为分液漏斗、b为圆底烧瓶,
故答案为:微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好;分液漏斗;圆底烧瓶;
(2)NaNO2和(NH4)2SO4反应生成氮气、硫酸钠与水,配平后方程式为:2NaNO2+(NH4)2SO4 2N2↑+Na2SO4+4H2O,
2N2↑+Na2SO4+4H2O,
故答案为:2NaNO2+(NH4)2SO4 2N2↑+Na2SO4+4H2O;
2N2↑+Na2SO4+4H2O;
(3)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置C除去氧气(及氮氧化物)、D干燥氮气,除去水蒸气,防止对E装置反应的影响;
C、D对调后无法除去水蒸气,故C、D不能对调,
故答案为:除去氧气(及氮氧化物);除去水蒸气;不能,对调后无法除去水蒸气;
(4)装置E中氮气与镁反应生成二氮化三镁,反应方程式为:N2+3Mg Mg3N2,
Mg3N2,
故答案为:N2+3Mg Mg3N2;
Mg3N2;
(5)取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;
弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁,
故答案为:取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁.
分析:(1)利用装置内气体热胀冷缩检验装置的气密性;
由图中仪器结构可知,a为分液漏斗、b为圆底烧瓶;
(2)NaNO2和(NH4)2SO4反应生成氮气、硫酸钠与水,配平书写方程式;
(3)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置C除去氧气(及氮氧化物)、D干燥氮气,防止对E装置反应的影响;
C、D对调后无法除去水蒸气;
(4)装置E中氮气与镁反应生成二氮化三镁;
(5)氮化镁水解生成氢氧化镁沉淀与氨气,氨气使湿润的红色石蕊试纸变蓝,据此设计证明有氮化镁生成;
若Mg有剩余,将上述反应后的上清液去掉,加入盐酸,有气泡生成,说明有Mg剩余.
点评:本题以氮化镁的制备为载体,考查学生对实验装置的理解、元素化合物的性质、实验方案的设计等,是对学生综合能力的考查,需要学生基本扎实的基础与分析问题、解决问题的能力.
由图中仪器结构可知,a为分液漏斗、b为圆底烧瓶,
故答案为:微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好;分液漏斗;圆底烧瓶;
(2)NaNO2和(NH4)2SO4反应生成氮气、硫酸钠与水,配平后方程式为:2NaNO2+(NH4)2SO4
 2N2↑+Na2SO4+4H2O,
2N2↑+Na2SO4+4H2O,故答案为:2NaNO2+(NH4)2SO4
 2N2↑+Na2SO4+4H2O;
2N2↑+Na2SO4+4H2O;(3)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置C除去氧气(及氮氧化物)、D干燥氮气,除去水蒸气,防止对E装置反应的影响;
C、D对调后无法除去水蒸气,故C、D不能对调,
故答案为:除去氧气(及氮氧化物);除去水蒸气;不能,对调后无法除去水蒸气;
(4)装置E中氮气与镁反应生成二氮化三镁,反应方程式为:N2+3Mg
 Mg3N2,
Mg3N2,故答案为:N2+3Mg
 Mg3N2;
Mg3N2;(5)取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;
弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁,
故答案为:取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁.
分析:(1)利用装置内气体热胀冷缩检验装置的气密性;
由图中仪器结构可知,a为分液漏斗、b为圆底烧瓶;
(2)NaNO2和(NH4)2SO4反应生成氮气、硫酸钠与水,配平书写方程式;
(3)装置内含有氧气、反应生成的气体中可能含有氮的氧化物,装置C除去氧气(及氮氧化物)、D干燥氮气,防止对E装置反应的影响;
C、D对调后无法除去水蒸气;
(4)装置E中氮气与镁反应生成二氮化三镁;
(5)氮化镁水解生成氢氧化镁沉淀与氨气,氨气使湿润的红色石蕊试纸变蓝,据此设计证明有氮化镁生成;
若Mg有剩余,将上述反应后的上清液去掉,加入盐酸,有气泡生成,说明有Mg剩余.
点评:本题以氮化镁的制备为载体,考查学生对实验装置的理解、元素化合物的性质、实验方案的设计等,是对学生综合能力的考查,需要学生基本扎实的基础与分析问题、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
氨气在工农业生产中有重要的用途.某校甲、乙两个化学小组分别对氨的相关实验进行了研究.
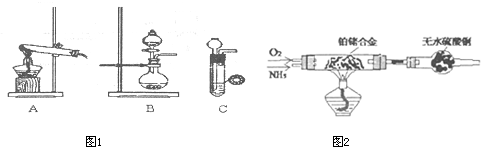
(1)甲、乙两小组选择了不同方法制(图1)取氨气,请将实验装置的字母编号和制备原理填写在下表空
格中.
(2)甲组通过图2装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是 ,硬质玻璃管中氨发生催化氧化反应的化学方程式为 .
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为 ,反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有 .
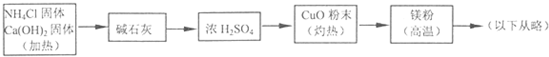
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3.乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向).你认为此方案是否正确,并说明理由 .

(1)甲、乙两小组选择了不同方法制(图1)取氨气,请将实验装置的字母编号和制备原理填写在下表空
格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ① |
| 乙小组 | ② |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO
| ||

氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。

(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
| 实验装置 | 实验药品 | 制备原理 |
甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ①??????????????????????????????? |
乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③??????????????????????????????? |
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____??????????????????????????????????????? ,硬质玻璃管中氨发生催化氧化反应的化学方程式为????????????????????????? 。

(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为?????????????????????? ,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有???????????????????? 。
??? (4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。
3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由????????????????????????????????????? 。
