题目内容
氨气在工农业生产中有重要的用途.某校甲、乙两个化学小组分别对氨的相关实验进行了研究.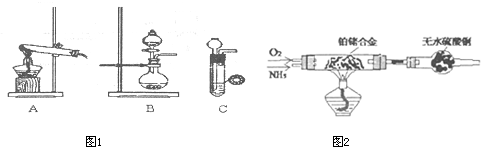
(1)甲、乙两小组选择了不同方法制(图1)取氨气,请将实验装置的字母编号和制备原理填写在下表空
格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为 ① |
| 乙小组 | ② |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为
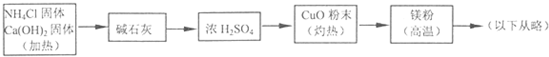
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO
| ||
分析:(1)①甲组是利用固体氯化铵和氢氧化钙加热反应生成氨气,是实验室制备氨气的方法;
②浓氨水和氢氧化钠固体制备氨气的方法是浓氨水滴入固体氢氧化钠中,利用氢氧化钠溶解放热使一水合氨分解生成氨气,选择装置B生成;
③浓氨水滴入固体氢氧化钠中放出大量的热,促使NH3的挥发;
(2)氨气和银通过装置图中铂铑合金做催化剂发生反应生成一氧化氮气体和水,一氧化氮和氧气反应得到红棕色二氧化氮气体,无水硫酸铜变蓝色证明反应生成水;
(3)足量氨气不断通入滴有酚酞的AgNO3溶液中.先生成白色沉淀氢氧化银,氢氧化银沉淀溶于过量氨水中生成银氨溶液,继续通入会形成一水合氨的碱性溶液,含酚酞的溶液变红色;
(4)依据流程分析判断,反应产生的NH3全部被H2SO4吸收.
②浓氨水和氢氧化钠固体制备氨气的方法是浓氨水滴入固体氢氧化钠中,利用氢氧化钠溶解放热使一水合氨分解生成氨气,选择装置B生成;
③浓氨水滴入固体氢氧化钠中放出大量的热,促使NH3的挥发;
(2)氨气和银通过装置图中铂铑合金做催化剂发生反应生成一氧化氮气体和水,一氧化氮和氧气反应得到红棕色二氧化氮气体,无水硫酸铜变蓝色证明反应生成水;
(3)足量氨气不断通入滴有酚酞的AgNO3溶液中.先生成白色沉淀氢氧化银,氢氧化银沉淀溶于过量氨水中生成银氨溶液,继续通入会形成一水合氨的碱性溶液,含酚酞的溶液变红色;
(4)依据流程分析判断,反应产生的NH3全部被H2SO4吸收.
解答:解:(1)①甲组是利用固体氯化铵和氢氧化钙加热反应生成氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;
②浓氨水和氢氧化钠固体制备氨气的方法是浓氨水滴入固体氢氧化钠中,利用氢氧化钠溶解放热使一水合氨分解生成氨气,选择装置B生成,
故答案为:B;
③浓氨水滴入固体氢氧化钠中,固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发,溶液中OH-浓度的增加也会促进平衡逆向进行生成氨气,
故答案为:固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O?NH3?H2O?NH4++OH-向生成NH3的方向移动;
(2)甲组通过图2装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是氨气被氧化为一氧化氮遇到氧气会反应生成红棕色二氧化氮气体,盛无水硫酸铜的固体变蓝色证明反应生成水,反应的化学方程式为:4NH3+5O2
4NO+6H2O,
故答案为:玻璃管中出现红棕色,干燥管中固体变蓝;4NH3+5O2
4NO+6H2O;
(3)足量氨气不断通入滴有酚酞的AgNO3溶液中.先生成白色沉淀氢氧化银,氢氧化银沉淀溶于过量氨水中生成银氨溶液,继续通入会形成一水合氨的碱性溶液,含酚酞的溶液变红色;反应的离子方程式为Ag++3NH3?H2O=Ag(NH3)2++OH-+2H2O+NH4+,溶液中的离子为Ag(NH3)2+、NO3-,
故答案为:先产生白色沉淀,后消失;溶液最后变成红色;Ag(NH3)2+、NO3-;
(4)流程中转化关系中氨气通入硫酸会被吸收,不能进行后续实验反应,故答案为:方案错误,反应产生的NH3全部被H2SO4吸收,不能进行后续反应.
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
②浓氨水和氢氧化钠固体制备氨气的方法是浓氨水滴入固体氢氧化钠中,利用氢氧化钠溶解放热使一水合氨分解生成氨气,选择装置B生成,
故答案为:B;
③浓氨水滴入固体氢氧化钠中,固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发,溶液中OH-浓度的增加也会促进平衡逆向进行生成氨气,
故答案为:固体NaOH溶于浓氨水后,放出大量的热,促使NH3的挥发;溶液中OH-浓度的增加,使NH3+H2O?NH3?H2O?NH4++OH-向生成NH3的方向移动;
(2)甲组通过图2装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是氨气被氧化为一氧化氮遇到氧气会反应生成红棕色二氧化氮气体,盛无水硫酸铜的固体变蓝色证明反应生成水,反应的化学方程式为:4NH3+5O2
| ||
| △ |
故答案为:玻璃管中出现红棕色,干燥管中固体变蓝;4NH3+5O2
| ||
| △ |
(3)足量氨气不断通入滴有酚酞的AgNO3溶液中.先生成白色沉淀氢氧化银,氢氧化银沉淀溶于过量氨水中生成银氨溶液,继续通入会形成一水合氨的碱性溶液,含酚酞的溶液变红色;反应的离子方程式为Ag++3NH3?H2O=Ag(NH3)2++OH-+2H2O+NH4+,溶液中的离子为Ag(NH3)2+、NO3-,
故答案为:先产生白色沉淀,后消失;溶液最后变成红色;Ag(NH3)2+、NO3-;
(4)流程中转化关系中氨气通入硫酸会被吸收,不能进行后续实验反应,故答案为:方案错误,反应产生的NH3全部被H2SO4吸收,不能进行后续反应.
点评:本题考查了实验室制备氨气的原理分析应用,注意氨气性质的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目


 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: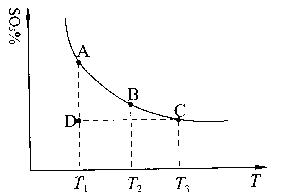

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”) )
) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

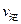 (填“>”、“<”或“=”)
(填“>”、“<”或“=”) )
) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
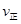
 (填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
 )
)