题目内容
下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A、相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3?H2O,c(NH4+)由大到小的顺序是:①>④>②>③ |
| B、常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| C、常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol?L-1 |
| D、物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:C(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.相同浓度的溶液,弱电解质溶液中铵根离子浓度最小,醋酸根离子促进铵根离子水解、铝离子抑制铵根离子水解,据此判断铵根离子浓度大小;
B.混合溶液呈中性,根据电荷守恒判断c(Na+)、c(CH3COO-)相对大小;
C.常温下,pH=6的NaHSO3溶液中中亚硫酸氢根离子电离程度大于水解程度,根据质子守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
B.混合溶液呈中性,根据电荷守恒判断c(Na+)、c(CH3COO-)相对大小;
C.常温下,pH=6的NaHSO3溶液中中亚硫酸氢根离子电离程度大于水解程度,根据质子守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断.
解答:
解:A.相同浓度的溶液,弱电解质溶液中铵根离子浓度最小,醋酸根离子促进铵根离子水解、铝离子抑制铵根离子水解,所以c(NH4+)由大到小的顺序是:①>②>③>④,故A错误;
B.混合溶液呈中性,根据电荷守恒得c(Na+)=c(CH3COO-)+c(Cl-),所以c(Na+)>c(CH3COO-),故B错误;
C.常温下,pH=6的NaHSO3溶液中中亚硫酸氢根离子电离程度大于水解程度,根据质子守恒得c(H2SO3)+c(H+)=c (OH-)+c(SO32-),所以c(H+)-c(OH-)=c(SO32-)-c(H2SO3)=9.9×10-7mol?L-1,故C正确;
D.任何电解质溶液中都存在物料守恒,根据物料守恒得2C(HClO)+2c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故D错误;
故选C.
B.混合溶液呈中性,根据电荷守恒得c(Na+)=c(CH3COO-)+c(Cl-),所以c(Na+)>c(CH3COO-),故B错误;
C.常温下,pH=6的NaHSO3溶液中中亚硫酸氢根离子电离程度大于水解程度,根据质子守恒得c(H2SO3)+c(H+)=c (OH-)+c(SO32-),所以c(H+)-c(OH-)=c(SO32-)-c(H2SO3)=9.9×10-7mol?L-1,故C正确;
D.任何电解质溶液中都存在物料守恒,根据物料守恒得2C(HClO)+2c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故D错误;
故选C.
点评:本题考查了离子浓度大小比较,根据溶液中溶质的性质及溶液酸碱性再结合守恒思想分析解答,注意B中还含有氯离子,为易错点.

练习册系列答案
相关题目
NA代表阿伏加德罗常数,以下说法正确的是( )
| A、22.4 L CO2中含有分子数为NA |
| B、物质的量浓度均为1 mol/L,体积均为1L的CH3COOH和HNO3溶液,电离出的H+数都为NA |
| C、1 L K2SO4溶液中N(K+)=4NA,则 c(K2SO4)=4 mol/L |
| D、常温常压下,28 g N2所含有的分子数为NA |
为了检验溴乙烷中含有溴元素,有以下操作,顺序合理的是( )
①加AgNO3溶液 ②加NaOH溶液 ③加热 ④加蒸馏水 ⑤加硝酸至溶液显酸性.
①加AgNO3溶液 ②加NaOH溶液 ③加热 ④加蒸馏水 ⑤加硝酸至溶液显酸性.
| A、②①③⑤ | B、②④⑤③ |
| C、②③⑤① | D、②①⑤③ |
分类是重要的科学研究方法,下列物质归类不正确的是( )
| A、电解质:明矾、氯气、冰醋酸、硫酸钡 |
| B、化合物:干冰、烧碱、冰水混合物、胆矾 |
| C、混合物:铝热剂、矿泉水、水玻璃、漂白粉 |
| D、同素异形体:C60、C70、金刚石 |
以下实验操作错误的是( )
| A、给试管里的固体加热时,试管口略向下倾斜 |
| B、给烧瓶里的液体加热时,垫上石棉网 |
| C、用燃着的酒精灯去点燃另一个酒精灯 |
| D、用托盘天平称量固体的质量时,砝码放在右盘 |
2006年10月16日美国与俄罗斯宣布,两国科学家合作成功合成了118号超重元素.对118号元素下列叙述合理的是( )
| A、它的最外层电子数是8 |
| B、它属于第VⅢ族 |
| C、它是活泼的金属元素 |
| D、它的中子数是118 |
下列实验操作方法及结论都正确的是( )
| A、向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl- |
| B、把H2O2滴入FeCl2溶液中,溶液由浅绿色变为棕黄色,证明H2O2有还原性 |
| C、向某溶液中加入稀 HCl,放出能使澄清的石灰水变浑浊的气体,证明有CO32- |
| D、向某溶液中加稀盐酸,无现象,再加入BaCl2溶液产生白色沉淀,证明有SO42- |
关于蛋白质的叙述不正确的是( )
| A、结晶牛胰岛素是我国科学家1965年首次合成的具有生命活力的蛋白质 |
| B、重金属盐类能使蛋白质凝结变性,所以误食重金属盐能使人中毒 |
| C、在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,若再加水,也不溶解 |
| D、浓HNO3溅在皮肤上能使皮肤呈现黄色,是由于浓HNO3和蛋白质发生了颜色反应 |
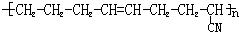 合成该高聚物的单体是
合成该高聚物的单体是