题目内容
取含MnO2的软锰矿石27.86g跟足量浓盐酸反应(杂质不参与反应),制得17.75gCl2(标准状况),反应原理如下:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
求:①这种软锰矿石中MnO2的百分含量.
②被氧化的HCl的物质的量.
③此时转移的电子的物质的量.
求:①这种软锰矿石中MnO2的百分含量.
②被氧化的HCl的物质的量.
③此时转移的电子的物质的量.
考点:氧化还原反应的计算
专题:
分析:n(Cl2)=
=0.25mol,
①根据氯气和MnO2之间的关系式计算MnO2的质量,再根据质量分数公式计算软锰矿石中MnO2的百分含量;
②被氧化是HCl完全转化为氯气,根据Cl原子守恒计算被氧化的HCl的物质的量;
③根据氯气和转移电子之间的关系式计算转移电子的物质的量.
| 17.75g |
| 71g/mol |
①根据氯气和MnO2之间的关系式计算MnO2的质量,再根据质量分数公式计算软锰矿石中MnO2的百分含量;
②被氧化是HCl完全转化为氯气,根据Cl原子守恒计算被氧化的HCl的物质的量;
③根据氯气和转移电子之间的关系式计算转移电子的物质的量.
解答:
解:n(Cl2)=
=0.25mol,
①设二氧化锰的质量为x,
MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
1 1
x 0.25 mol
1:1=x:0.25mol
x=
=0.25mol,
二氧化锰的质量分数=
×100%=78%,
答:这种软锰矿石中MnO2的百分含量为78%;
②HCl被氧化完全转化为氯气,根据Cl原子守恒得n(HCl)=2n(Cl2)=0.25mol×2=0.5mol,
答:被氧化HCl的物质的量为0.5mol;
③设转移电子的物质的量为y,
MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O 转移电子
1 2
0.25 mol y
1:2=0.25mol:y,
y=
=0.5mol,
答:转移电子的物质的量为0.5mol.
| 17.75g |
| 71g/mol |
①设二氧化锰的质量为x,
MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
1 1
x 0.25 mol
1:1=x:0.25mol
x=
| 0.25mol×1 |
| 1 |
二氧化锰的质量分数=
| 0.25mol×87g/mol |
| 27.86g |
答:这种软锰矿石中MnO2的百分含量为78%;
②HCl被氧化完全转化为氯气,根据Cl原子守恒得n(HCl)=2n(Cl2)=0.25mol×2=0.5mol,
答:被氧化HCl的物质的量为0.5mol;
③设转移电子的物质的量为y,
MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O 转移电子
1 2
0.25 mol y
1:2=0.25mol:y,
y=
| 0.25mol×2 |
| 1 |
答:转移电子的物质的量为0.5mol.
点评:本题考查氧化还原反应的计算,侧重考查学生分析问题、计算能力,根据方程式、关系式或守恒思想计算即可,题目难度不大.

练习册系列答案
相关题目
下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的气体(暂不考虑尾气吸收).关于这些装置的接,下列说法正确的是( )
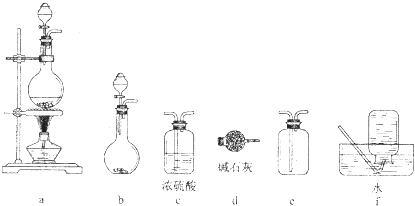

| A、制备收集C2H4:连接a→d→f |
| B、制备收集NO2:连接a→c→f |
| C、制备收集Cl2:连接a→d→e |
| D、制备收集NH3:连接b→→e |
相同质量的下列物质,所含分子数目最多的是( )
| A、CH4 |
| B、NH3 |
| C、H2O |
| D、Cl2 |
NA代表阿伏加德罗常数,下列说法正确的是( )
| A、28g氮气含有NA个原子 |
| B、标准状况下,22.4LH2O含有NA个H2O分子 |
| C、1mol/L的硝酸钠溶液中含有的硝酸根离子数为NA |
| D、甲烷的摩尔质量与NA个甲烷分子的质量在数值上相等 |