��Ŀ����
��֪��Ӧ
��CO(g)��H2O(g)(1)
��1 mol��CO��1 mol��H2O(g)����ij�̶��ݻ��ķ�Ӧ������ij�¶��´ﵽƽ������ʱ��2/3��COת��ΪCO2����÷�Ӧƽ�ⳣ���ı���ʽΪ________�����¶���ƽ�ⳣ��Ϊ________��(2)
������ͬ����������������г���1 mol��CO2��1 mol��H2����ﵽƽ��ʱ��(1)��Ƚ���ƽ��Ӧ________�ƶ�(�������Ӧ���������淴Ӧ������)����ʱƽ��������CO2���������Լ�����и�ֵ�е�________(����)A��22.2��
B��27.55��
C��33.3��
D��36.8��
(3)
������ͬ����������������г���1 mol��CO2��1 mol��H2��1 mol��H2O(g)����ﵽƽ��ʱ��(1)��Ƚ���������˵������ȷ����________(�����)��������IJ���һ������
�ڷ�Ӧ���Ũ��һ������
�۷�Ӧ���ת����һ������
��
CO��ƽ�������еİٷֺ���һ������������
|
����(1)Kc�� ����(2)����C ����(3)�٢� |

��8�֣���֪��Ӧ��CO(g) + H2O(g)H2(g) + CO2(g) ��H= Q kJ��mol-1����ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.94 | 9 | 1 |
��ش��������⣺
��1���������淴Ӧ��Q 0������ڡ���С�ڡ�����
��2��850��ʱ�����Ϊ10L��Ӧ���У�ͨ��һ������CO��H2O��g������������Ӧ��CO��H2O(g)Ũ�ȱ仯����ͼ���Իش�
��0��4 min��ƽ����Ӧ����v(CO)=______ mol/(L��min)
�����б�������Ϊ�ÿ��淴Ӧ�ﵽƽ���־����__________(�����)��
A�������������ܶȱ��ֲ���ʱ
B������Ӧ����0.1molCO(g)ͬʱҲ����0.1molH2O(g)ʱ
C����CO(g)�������������ֲ���ʱ
D�����÷�Ӧ�Ħ�H����ʱ
��3����Ҫ�ӿ�÷�Ӧ���ʣ�ͬʱ��Ҫ���CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩΪ_____(�����)��
A������ˮ�������� B�������¶�
C��ʹ�ô��� D������ѹǿ E����������CO2
��8�֣���֪��Ӧ��CO(g) + H2O(g) H2(g) + CO2(g) ��H=" Q" kJ��mol-1����ƽ�ⳣ�����¶ȵı仯���±���
H2(g) + CO2(g) ��H=" Q" kJ��mol-1����ƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 850 |
| ƽ�ⳣ�� | 9.9 4 4 | 9 | 1 |
��1���������淴Ӧ��Q 0������ڡ���С�ڡ�����
��2��850��ʱ�����Ϊ10L��Ӧ���У�ͨ��һ������CO��H2O��g������������Ӧ��CO��H2O(g)Ũ�ȱ仯����ͼ���Իش�
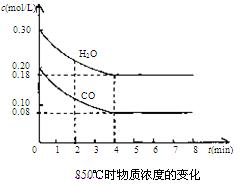
��0��4 min��ƽ����Ӧ����v(CO)="______" mol/(L��min)
�����б�������Ϊ�ÿ��淴Ӧ�ﵽƽ���־����__________(�����)��
A�������������ܶȱ��ֲ���ʱ
B������Ӧ����0.1molCO(g) ͬʱҲ����0.1molH2O(g)ʱ
C����CO(g)�������������ֲ���ʱ
D�����÷�Ӧ�Ħ�H����ʱ
��3����Ҫ�ӿ�÷�Ӧ���ʣ�ͬʱ��Ҫ���CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩΪ_____(�����)��
A������ˮ�������� B�������¶�
C��ʹ�ô��� D������ѹǿ E����������CO2
��8�֣���֪��Ӧ��CO(g) + H2O(g) H2(g) + CO2(g) ��H= Q kJ��mol-1����ƽ�ⳣ�����¶ȵı仯���±���
|
�¶�/�� |
400 |
500 |
850 |
|
ƽ�ⳣ�� |
9.94 |
9 |
1 |
��ش��������⣺
��1���������淴Ӧ��Q 0������ڡ���С�ڡ�����
��2��850��ʱ�����Ϊ10L��Ӧ���У�ͨ��һ������CO��H2O��g������������Ӧ��CO��H2O(g)Ũ�ȱ仯����ͼ���Իش�
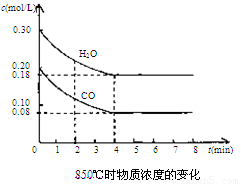
��0��4 min��ƽ����Ӧ����v(CO)=______ mol/(L��min)
�����б�������Ϊ�ÿ��淴Ӧ�ﵽƽ���־����__________(�����)��
A�������������ܶȱ��ֲ���ʱ
B������Ӧ����0.1molCO(g) ͬʱҲ����0.1molH2O(g)ʱ
C����CO(g)�������������ֲ���ʱ
D�����÷�Ӧ�Ħ�H����ʱ
��3����Ҫ�ӿ�÷�Ӧ���ʣ�ͬʱ��Ҫ���CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩΪ_____(�����)��
A������ˮ�������� B�������¶�
C��ʹ�ô��� D������ѹǿ E����������CO2

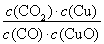
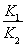
 H2(g)+CO2(g)
H2(g)+CO2(g)