题目内容
5.现有A、B、C、D、E、F、G、H八种原子序数依次增加的前四周期元素.其中A的最低负价和最高正价代数和为零且A2常温下为气态,B与其他元素形成化合物种类最多,C与E可形成EC2和EC3两种物质,D是短周期最活泼的金属元素,F的一种氧化物可以做白色颜料,G是前四周期未成对电子数最多的元素,E和H的质子数之和等于F和G的质子数之和.回答下列问题:(1)G的价电子排布图
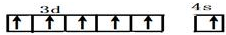 ,B在元素周期表的位置第二周期第ⅣA族
,B在元素周期表的位置第二周期第ⅣA族(2)DA是目前应用较为广泛的新型无机材料,其电子式为Na+[:H]-
(3)比较C、D、E的常见离子的离子半径大小S2->O2->Na+(由大及小)
(4)F可与卤素元素单质反应生成FX4型化合物,该化合物可发生水解反应,试写出水解反应的化学方程式TiX4+(x+2)H2O=TiO2.xH2O+4HX
(5)向含G元素的某溶液中滴加盐酸,溶液颜色发生变化,解释其原因存在Cr2O72-+H2O?2CrO42-+2H+,氢离子浓度增大,平衡向逆反应方向进行,溶液颜色由黄色变成橙黄色
(6)E、H形成某种晶体的晶胞与金刚石晶胞相似.
①E的最高价氧化物的浓溶液与H的单质发生反应的离子方程式是:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Zn2++SO2↑+SO42-+2H2O
②设该晶体的密度为a g/cm3,E原子与最近的H原子距离为b pm,则阿伏伽德罗常数的表示为$\frac{4×97}{(\frac{4\sqrt{3}}{3}b×1{0}^{-10})^{3}×a}$(列式计算)
分析 现有A、B、C、D、E、F、G、H八种原子序数依次增加的前四周期元素.其中A的最低负价和最高正价代数和为零且A2常温下为气态,则A为氢元素;B与其他元素形成化合物种类最多,则B为碳元素;C与E可形成EC2和EC3两种物质,则C为O元素、E为S元素;D是短周期最活泼的金属元素,则D为Na;G是前四周期未成对电子数最多的元素,应处于第四周期,外围电子排布为3d54s1,则G为Cr;F的一种氧化物可以做白色颜料,则F为Ti;E和H的质子数之和等于F和G的质子数之和,则H的质子数=22+24-16=30,故H为Zn,据此解答.
解答 解:现有A、B、C、D、E、F、G、H八种原子序数依次增加的前四周期元素.其中A的最低负价和最高正价代数和为零且A2常温下为气态,则A为氢元素;B与其他元素形成化合物种类最多,则B为碳元素;C与E可形成EC2和EC3两种物质,则C为O元素、E为S元素;D是短周期最活泼的金属元素,则D为Na;G是前四周期未成对电子数最多的元素,应处于第四周期,外围电子排布为3d54s1,则G为Cr;F的一种氧化物可以做白色颜料,则F为Ti;E和H的质子数之和等于F和G的质子数之和,则H的质子数=22+24-16=30,故H为Zn.
(1)G为Cr,外围电子排布为3d54s1,G的价电子排布图为 ,B为碳元素,在元素周期表的位置:第二周期第ⅣA族,
,B为碳元素,在元素周期表的位置:第二周期第ⅣA族,
故答案为: ;第二周期第ⅣA族;
;第二周期第ⅣA族;
(2)NaH属于离子化合物,其电子式为Na+[:H]-,
故答案为:Na+[:H]-;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->O2->Na+,
故答案为:S2->O2->Na+;
(4)F可与卤素元素单质反应生成TiX4型化合物,该化合物可发生水解反应,水解反应的化学方程式:TiX4+(x+2)H2O=TiO2.xH2O+4HX,
故答案为:TiX4+(x+2)H2O=TiO2.xH2O+4HX;
(5)存在Cr2O72-+H2O?2CrO42-+2H+,氢离子浓度增大,平衡向逆反应方向进行,溶液颜色由黄色变成橙黄色,
故答案为:存在Cr2O72-+H2O?2CrO42-+2H+,氢离子浓度增大,平衡向逆反应方向进行,溶液颜色由黄色变成橙黄色;
(6)①E的最高价氧化物的浓溶液为浓硫酸,与Zn单质发生反应的离子方程式是:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Zn2++SO2↑+SO42-+2H2O,
故答案为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Zn2++SO2↑+SO42-+2H2O;
②金刚石晶胞中4个碳原子位于晶胞内部,面心、顶点均有碳原子,则晶胞中碳原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,S、Zn形成某种晶体的晶胞与金刚石晶胞相似,则ZnS晶胞中含有4个Zn、4个S原子,晶胞质量为4×$\frac{97}{{N}_{A}}$g,Zn原子与最近的S原子距离为b pm,则晶胞体对角线长度为4b pm,故晶胞棱长为$\frac{\sqrt{3}}{3}$×4b pm,则晶胞体积为($\frac{\sqrt{3}}{3}$×4b×10-10 cm)3,则($\frac{\sqrt{3}}{3}$×4b×10-10 cm)3×a g/cm3=4×$\frac{97}{{N}_{A}}$g,解得NA=$\frac{4×97}{(\frac{4\sqrt{3}}{3}b×1{0}^{-10})^{3}×a}$,
故答案为:$\frac{4×97}{(\frac{4\sqrt{3}}{3}b×1{0}^{-10})^{3}×a}$.
点评 本题是对物质结构的考查,推断元素是解题关键,(6)中计算为难点,需要学生具备扎实的基础与一定数学计算能力,熟记中学常见晶胞结构,难度较大.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案| A. | 1:1:1 | B. | 3:2:1 | C. | 6:3:2 | D. | 1:2:3 |
| A. | 由不同原子构成的纯净物一定是化合物 | |
| B. | 非金属氧化物一定是酸性氧化物 | |
| C. | 含金属元素的离子一定都是阳离子 | |
| D. | 胆矾是纯净物,水泥是混合物 |
| A. | Ca(ClO)2中Cl元素化合价为-1价 | |
| B. | Ca(OH)2在该反应中失去电子,表现出还原性 | |
| C. | Cl2既是氧化剂又是还原剂 | |
| D. | 若有1molCl2参加反应,则转移2mol电子 |
| 事实 | 结论 | |
| A | A原子、B原子价电子数分别为1、2 | A的金属性一定比B的强 |
| B | 某气态单质X与H2通常条件下不能共存 | 在化合物中,X元素只能呈负价 |
| C | 元素的非金属性M>N | 含氧酸的酸性M>N |
| D | Q分子间存在氢键而P分子间无氢键 | Q的沸点一定比P的高 |
| A. | A | B. | B | C. | C | D. | D |
 (1)检验食盐中是否加碘,可利用如下反应:
(1)检验食盐中是否加碘,可利用如下反应: