题目内容
体积相同的甲乙两容器中,分别充入1molA和1molB,在相同温度下发生反应:2A(g)+B(g)?2C(g) 并达到平衡,甲容器保持体积不变,C的体积分数为m%;乙容器保持压强不变,C的体积分数为n%,则m和n的正确关系为( )
| A、m<n | B、m=n |
| C、m>n | D、无法比较 |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:甲为恒温恒容容器,乙为恒温恒压容器,若保持温度相同,分别向两个容器中通入1mol A和1mol B,由于反应是向着气体体积减小的方向进行的,所以甲中反应达到平衡压强减小,而乙容器中反应达到平衡,为保持恒压,反应过程中压强大于甲容器,所以最后达到平衡后,C的体积分数大于甲容器中C的体积分数.
解答:
解:甲为恒温恒容容器反应达到平衡,乙为恒温恒压容器,达到平衡过程中需要保持压强不变,若保持温度相同,分别向两个容器中通入1mol A和1mol B,由于反应是向着气体体积减小的方向进行的,所以甲中反应达到平衡压强减小,乙容器中反应达到平衡,为保持恒压,反应过程中压强大于甲容器,所以最后达到平衡后,C的体积分数大于甲容器中C的体积分数,即m<n,
故选:A.
故选:A.
点评:本题考查了恒温恒容、恒温恒压容器中的反应达到平衡的过程分析判断,掌握容器的特征和条件是解题关键,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:阳极质量不变;a阳极质量不变,b阴极质量增加;c电解液pH减小,则应选用的电极是( )
①阴阳两极都用石墨
②铜作阳极铁作阴极
③铁作阳极铜作阴极
④铂作阳极铜作阴极.
①阴阳两极都用石墨
②铜作阳极铁作阴极
③铁作阳极铜作阴极
④铂作阳极铜作阴极.
| A、①③ | B、①② | C、③④ | D、①④ |
甲、乙两容器都发生反应 2A(g)+B(g)?xC(g),两容器温度和初始压强都相同.甲容器中充入 2molA 和 1molB,达平衡后,C在平衡混合气中的体积分数为φ、物质的量为 n1;乙容器中充入 1.4molA,0.7molB 和 0.6molC,达平衡后C在平衡混合气中的体积分数为φ、物质的量为n2.下列说法中正确的是( )
| A、若甲、乙两容器均为恒容容器,则x必等于2 |
| B、若甲、乙两容器均为恒压容器,则x必等于3 |
| C、若甲为恒容容器、乙为恒压容器,且 x=3,则 n1必大于n2 |
| D、若甲为恒压容器、乙为恒容容器,且 x≠3,则 n1必大于n2 |
取pH=4的某电解质溶液 1.00L,用 Pt电极进行电解,经过一段时间后,测得溶液的pH=1,且阴阳两极产物的物质的量之比为2:1,则该电解质溶液是( )
| A、盐酸 | B、氯化钾溶液 |
| C、硝酸银溶液 | D、硫酸铜溶液 |
可逆反应 2X+Y?2Z(g)△H<0,气体的平均摩尔质量(M)随温度的降低而增大.则下列说法正确的是( )
| A、X和Y可能都是固体 |
| B、X和Y一定都是气体 |
| C、若Y为固体,X一定是气体 |
| D、X和Y不可能都是气体 |
恒温恒压下,在容积可变的密闭容器中发生反应:A(g)+B(g)?C(g).若开始时通入1molA和1mol B,达到平衡后生成a mol C,则下列说法错误的是( )
| A、若开始通入3mol A和3mol B,达到平衡后将生成3a mol C | ||
| B、若开始通入3mol A、2mol B和1mol C,达到平衡后密闭容器中C的物质的量可能为3mol | ||
| C、若开始时通入2mol A、2mol B和1mol C,达到平衡时,B的物质的量一定小于2mol | ||
D、若开始时通入2molA、2mol B和1mol C,达到平衡后,再通入2 mol C,则再次到达平衡后,C的物质的量分数为
|
下列说法不正确的是( )
| A、检验SO42-的试剂是HCl和BaCl2 |
| B、检验Cl-的试剂是AgNO3和HNO3 |
| C、向溶液中加入BaCl2后生成白色沉淀,即证明有SO42- |
| D、检验CO32-的试剂HCl,澄清的石灰水,和CaCl2 |
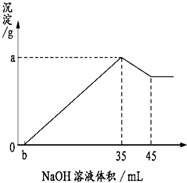 准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,
准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)加入100mL硫酸溶液,充分反应后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量与加入NaOH溶液的体积关系如图所示,求所用硫酸溶液的物质的量浓度( )
| A、1.75 mol/L |
| B、3.5 mol/L |
| C、2.25 mol/L |
| D、无法计算 |
 用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )
用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )