题目内容
17.除去溴苯中少量溴的方法是( )| A. | 加入苯使之反应 | B. | 加入较大量的CCl4萃取静置后分液 | ||
| C. | 加入KI溶液 | D. | 加入较大量NaOH溶液后静置分液 |
分析 溴易溶于苯,不易溶于水,可选择NaOH溶液与溴反应,反应后与苯分层,然后分液可除杂,以此来解答.
解答 解:A.加入苯不能除杂,故A错误;
B.加入较大量的CCl4,互溶不分层,故B错误;
C.加入KI与溴反应生成的碘易溶于苯,引入新杂质,故C错误;
D.加入较大量NaOH溶液后,溴与NaOH反应,与苯分层,则静置分液可除杂,故D正确;
故选D.
点评 本题考查物质分离提纯方法和选择,为高频考点,把握物质的性质及性质差异为解答的关键,注意除杂不能引入新杂质及有机物的溶解性,题目难度不大.

练习册系列答案
相关题目
7.下列有关能量转换的说法正确的是( )
| A. | 铅蓄电池的放电过程是电能转化为化学能 | |
| B. | 化石燃料和植物燃料燃烧时放出的能量是化学能转化为光能 | |
| C. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| D. | 植物通过光合作用将CO2转化为葡萄糖是太阳能大部分转变成化学能的过程 |
8.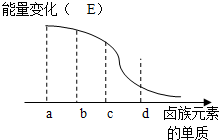 A、B、C、D为按顺序排列的前四种卤素单质,仔细分析下表中的数据,回答有关问题.
A、B、C、D为按顺序排列的前四种卤素单质,仔细分析下表中的数据,回答有关问题.
(1)在标准状况下为液体的卤素单质是C (填字母,下同),为固体的卤素单质是D.
(2)A的相对分子质量为38(保留整数)
(3)写出B与水反应的化学方程式Cl2+H2O=HCl+HClO
(4)卤素单质B、C、D的氧化性由大到小的顺序为Cl2>Br2>I2(用化学式表示)
(5 )卤族元素的单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示卤族中某一元素的单质,E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:d为I2(写化学式,下同),红热的铜丝在b单质中燃烧的现象为剧烈燃烧,产生棕黄色的烟..
 A、B、C、D为按顺序排列的前四种卤素单质,仔细分析下表中的数据,回答有关问题.
A、B、C、D为按顺序排列的前四种卤素单质,仔细分析下表中的数据,回答有关问题.| 卤素单质 | 密度(标准状况下) | 沸点/℃ | 熔点/℃ | 溶解度(标准状况下,100g水中) |
| A | 1.696 g•l-1 | -188.1 | -219.6 | -- |
| B | 3.214 g•l-1 | -34.6 | -101 | 226 cm3 |
| C | 3.119 g•cm-3 | 58.78 | -7.2 | 4.16 g |
| D | 4.93 g•cm-3 | 184.4 | 113.5 | 0.029 g |
(2)A的相对分子质量为38(保留整数)
(3)写出B与水反应的化学方程式Cl2+H2O=HCl+HClO
(4)卤素单质B、C、D的氧化性由大到小的顺序为Cl2>Br2>I2(用化学式表示)
(5 )卤族元素的单质与H2反应过程中的能量变化如图所示,其中a、b、c、d分别表示卤族中某一元素的单质,E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:d为I2(写化学式,下同),红热的铜丝在b单质中燃烧的现象为剧烈燃烧,产生棕黄色的烟..
12.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH═2K2FeO4+6KCl+8H2O.对于该反应,下列说法正确的是( )
| A. | 该该反应是氧化还原反应 | B. | 钾元素化合价降低 | ||
| C. | 铁元素化合价不变 | D. | 反应是置换反应 |
2.V L Al2(SO4)3溶液中含a gSO42-取此溶液$\frac{V}{2}$L用水稀释成2V L,则稀释后溶液的c(Al3+)(单位为mol/L)( )
| A. | $\frac{a}{576V}$ | B. | $\frac{125a}{36}$V | C. | $\frac{250}{36}$V | D. | $\frac{250a}{48}$V |
6. 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )| A. | 液滴中的Cl-由a区向b区迁移 | |
| B. | 液滴中心是正极区,发生的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成 Fe(OH)2,进一步氧化、脱水形成铁锈 | |
| D. | 若改用嵌有一铜螺丝钉铁板,在铜铁接触处滴加NaCl溶液,则负极:Fe-2e-═Fe2+ |
7.下列氧化还原反应中,水做还原剂的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 3NO2+H2O═NO+2HNO3 | ||
| C. | CO+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2+H2 | D. | 2F2+2H2O═4HF+O2 |
