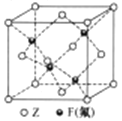
题目内容
【题目】25℃时,向0.1molL-1NaA溶液中逐滴滴加盐酸,测得混合溶液的pH与p![]() 变化关系如图所示[p
变化关系如图所示[p![]() =-lg
=-lg![]() ]。下列说法正确的是( )
]。下列说法正确的是( )
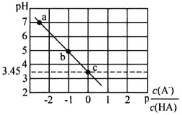
A.a点溶液中c(Na+)=c(A-)
B.电离常数K(HA)的数量级为10-4
C.滴加过程中![]() 不断减小
不断减小
D.b点溶液中c(HA)>c(Na+)>c(A-)>c(OH-)
【答案】B
【解析】
A.从图中信息可以看出a点溶液为中性即氢离子浓度等于氢氧根离子浓度,由电荷守恒可知:![]() 所以
所以![]() ,故A 错误;
,故A 错误;
B. ,横坐标为0时,
,横坐标为0时, ,这时pH为
,这时pH为![]() , p
, p =lg
=lg =0,
=0, =1,Ka(HA)=
=1,Ka(HA)= =c(H+)=103.45,则Ka(HA)的数量级为104,故B正确;
=c(H+)=103.45,则Ka(HA)的数量级为104,故B正确;
C. p =lg
=lg =lg
=lg  =lg
=lg![]() ,温度不变,Ka(HA)、Kw不变,则滴加过程中p
,温度不变,Ka(HA)、Kw不变,则滴加过程中p 保持不变,故C错误;
保持不变,故C错误;
D.b点溶液中,pH=5,p =lg
=lg =1,
=1, =10,则c(HA)<c(A),根据物料守恒c(Na+)=c(HA)+c(A)可知,c(Na+)>c(A),正确的离子浓度大小为:c(Na+)>c(A)>c(HA) >c(OH),故D错误;
=10,则c(HA)<c(A),根据物料守恒c(Na+)=c(HA)+c(A)可知,c(Na+)>c(A),正确的离子浓度大小为:c(Na+)>c(A)>c(HA) >c(OH),故D错误;
答案选B。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
Ⅰ.测定过氧化氢的含量
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为________。
(3)判断滴定到达终点的现象是_________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
实验内容 | 实验方法 | 实验现象 |
验证氧化性 | ____________ | ____________ |
验证不稳定性 | ____________ | ____________ |