题目内容
15.下列关于H3O+的说法中不正确的是( )| A. | 1个H3O+中有3个σ键 | B. | 中心原子上有1对孤对电子 | ||
| C. | H3O+的立体构型是三角锥形 | D. | O-H键之间的夹角:H3O+<H2O |
分析 根据VSEPR理论和杂化轨道理论判断H3O+的空间构型和杂化轨道类型,判断键角大小,据此分析判断.
解答 解:对于H3O+,根据VSEPR理论,中心O原子的配位原子数为BP=3,孤电子对数为LP=$\frac{6-1×3-1}{2}$=1,则价电子对数为VP=BP+LP=3+1=4,根据杂化轨道理论,中心O原子为sp3杂化,
A.H3O+中中心O为sp3杂化,有4个sp3杂化轨道,而成键是3根键,还有一对孤电子对,则1个H3O+中有3个σ键,故A正确;
B.中心O上存在一对孤电子对,占据正四面体形的一个顶点,故B正确;
C.sp3杂化的粒子的理论空间构型为正四面体形,由于H3O+中存在一对孤电子对占据正四面体形的一个顶点,因此粒子的立体构型为三角锥形,故C正确;
D.H3O+中含有1对孤电子对,H2O中含有2对孤电子对,由于孤电子对斥力大于键合电子对斥力,孤电子对数目越多,键角越小,因此O-H键之间的夹角:H3O+>H2O,故D错误.
故选D.
点评 本题考查价层电子对互斥理论和杂化轨道理论判断H3O+的空间构型,知道孤电子对斥力大于键合电子对斥力是关键,孤电子对数越多,斥力越大,键角就越小,本题难度不大,是基础题.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
20.下列物质能使潮湿的有色布条褪色的是( )
| A. | HCl | B. | NaCl | C. | CO2 | D. | 干燥的氯气 |
1.在一密闭容器中,反应a A(g)?b B(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则( )
| A. | 平衡向正反应方向移动了 | B. | 物质B的质量分数减小了 | ||
| C. | 物质A的转化率减少了 | D. | a>b |
3.为研究哈伯法合成氨反应,T℃时,在容积为2L恒容容器中通入4mol N2和12mol H2,反应如下:
N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-92kJ/mol
相关键能数据如下:
若25min时反应达到平衡,各物质浓度随时间变化曲线如图中甲、乙、丙.回答下列问题:

(1)0-25min内,反应的平均速率v(H2)为0.12mol/(L•min);表中x=391.
(2)T℃时,该反应的平衡常数K=$\frac{4}{27}$L2/mol2(用最简分数表达).
(3)T℃时,若起始充入8molN2和24molH2,则反应刚达到平衡时,表示c(H2)在图中相应的点为B(填字母).
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s)+H2O(g)?CO(g)+H2(g)△H1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2
若已知CO和H2的燃烧热分别为283KJ•mol-1和285.8KJ•mol-1
H2O(g)=H2O(l)△H=-44kJ/mol,则△H2=-41.2kJ/mol.
(5)氨气是生产硝酸的重要原料,其过程如图1:

写出步骤I的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(6)图2是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:由图可知,把电极B是电解池的阳极(填“阴极”或“阳极”);把电极A上的电极反应式为N2+6e-+6H+=2NH3.
N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-92kJ/mol
相关键能数据如下:
| N≡N | H-H | N-H | |
| 键能数据(KJ/mol) | 946 | 436 | x |

(1)0-25min内,反应的平均速率v(H2)为0.12mol/(L•min);表中x=391.
(2)T℃时,该反应的平衡常数K=$\frac{4}{27}$L2/mol2(用最简分数表达).
(3)T℃时,若起始充入8molN2和24molH2,则反应刚达到平衡时,表示c(H2)在图中相应的点为B(填字母).
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s)+H2O(g)?CO(g)+H2(g)△H1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2
若已知CO和H2的燃烧热分别为283KJ•mol-1和285.8KJ•mol-1
H2O(g)=H2O(l)△H=-44kJ/mol,则△H2=-41.2kJ/mol.
(5)氨气是生产硝酸的重要原料,其过程如图1:

写出步骤I的化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(6)图2是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:由图可知,把电极B是电解池的阳极(填“阴极”或“阳极”);把电极A上的电极反应式为N2+6e-+6H+=2NH3.
10.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| D. | 元素原子的最外层电子数等于元素的最高化合价 |
20.下列说法正确的是( )
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 | |
| C. | MgCl2属于离子化合物,其中既含有离子键又含有共价键 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
7.下列化学用语表达正确的是( )
| A. | 乙醇的分子式 C2H5OH | B. | 苯分子的实验式为CH | ||
| C. | 次氯酸的电子式 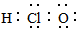 | D. | 乙烯的结构简式 CH2CH2 |
4.下列各项中表达正确的是( )
| A. | 硫离子(S2-)的核外电子排布式:1s22s22p63s23p6 | |
| B. | N2的结构式::N≡N: | |
| C. | NaCl的电子式: | |
| D. | CO2的分子模型示意图: |
3.下列叙述正确的是( )
| A. | C5H11Cl有8种同分异构体 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 聚氯乙烯与乙烯性质相似,可使溴水褪色 | |
| D. | 相同条件下,熔沸点:正丁烷<异丁烷 |