题目内容
12.下列可以实验海水淡化的实验操作是( )| A. | 过滤 | B. | 蒸发 | C. | 蒸馏 | D. | 萃取 |
分析 海水淡化水,应将水与盐分离,可用蒸馏、电渗析或离子交换法等,以此解答.
解答 解:A.过滤只能除去水中的不溶性杂质,不能淡化海水,故A错误;
B.蒸发得到食盐,不能得到淡化水,故B错误;
C.蒸馏法是把水从水的混合物中分离出来,得到纯净的水,故C正确;
D.萃取用于分离在不同溶剂中的溶解度不同的物质,海水中存在大量的盐,不能用萃取的方法淡化,故D错误.
故选C.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质的异同,为解答该题的关键,难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
12.某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:6 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
7.下列说法正确的是( )


| A. | Cl2的水溶液能导电,所以Cl2是电解质 | |
| B. | 用铂丝蘸取NaCl溶液进行焰色反应是化学变化 | |
| C. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸 | |
| D. | 按照如图操作,配制0.10 mol•L-1 NaOH溶液 |
17.现有部分短周期元素的性质或原子结构如表:
(1)X3Y、X2T、XZ都是离子化合物,这三种化合物中所涉及离子的半径由大到小的顺序是Cl->S2->N3->Na+(用离子符号表示).
(2)T与Z的氢化物的稳定性:HCl>H2S(填化学式),依据是Cl的非金属性大于S,则HCl的稳定性大于H2S.
(3)写出W的单质与X的最高价氧化物对应的水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)Y的一种液态氢化物Y2H4具有强还原性,能与溴化银反应生成黑色银粒,本身被氧化成Y单质,写出发生反应的化学方程式:N2H4+4AgBr=4Ag+N2↑+4HBr,该反应中氧化产物的电子式为 .
.
| 元素 | 元素性质或原子结构 |
| T | 元素最高正价是+6 |
| X | 在短周期元素中原子半径最大 |
| Y | 氢化物与最高价氧化物对应的水化物反应生成盐 |
| Z | M层上有7个电子 |
| W | 其单质既能跟酸反应,又能跟碱反应,且都产生H2 |
(2)T与Z的氢化物的稳定性:HCl>H2S(填化学式),依据是Cl的非金属性大于S,则HCl的稳定性大于H2S.
(3)写出W的单质与X的最高价氧化物对应的水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)Y的一种液态氢化物Y2H4具有强还原性,能与溴化银反应生成黑色银粒,本身被氧化成Y单质,写出发生反应的化学方程式:N2H4+4AgBr=4Ag+N2↑+4HBr,该反应中氧化产物的电子式为
 .
.
2.化学与生产、生活密切相关. 下列说法不正确的是( )
| A. | 福尔马林可浸制标本,因其可使蛋白质变性的性质 | |
| B. | 向牛奶中加入果汁会产生沉淀,这是因为发生了酸碱中和反应 | |
| C. | 将地沟油制成肥皂,可以提高资源的利用率 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
 a、b、c、d、e、f是原子序数依次增大的6种短周期元素,a、d同主族,a是原子半径最小的元素,b的最高正化合价与最低负化合价的代数和为零,a与c、d与c均可形成原子个数之比为2:1和1:1的化合物,d、e的最外层电子数之和等于b的最外层电子数,f是同周期中得电子能力最强的元素.
a、b、c、d、e、f是原子序数依次增大的6种短周期元素,a、d同主族,a是原子半径最小的元素,b的最高正化合价与最低负化合价的代数和为零,a与c、d与c均可形成原子个数之比为2:1和1:1的化合物,d、e的最外层电子数之和等于b的最外层电子数,f是同周期中得电子能力最强的元素. .a、c、d三种元素形成的化合物中存在的化学键类型是离子键、共价键.
.a、c、d三种元素形成的化合物中存在的化学键类型是离子键、共价键.
 ;
; .
.
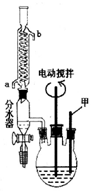 苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g•cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇.实验室中由甲苯(式量:92,密度为0.8669g•cm-3)制备苯甲酸的实验如下:
苯甲酸(C6H5COOH式量:122,熔点122.4℃,密度为1.2659g•cm-3)是一种一元有机弱酸,微溶于水易溶于乙醇.实验室中由甲苯(式量:92,密度为0.8669g•cm-3)制备苯甲酸的实验如下: