题目内容
含11.2g KOH的稀溶液与1L 0.12mol/L的H2SO4溶液反应放出11.46kJ的热量。该反应的热化学方程式是
- A.KOH(aq)+1/2H2SO4(aq)==1/2K2SO4(aq)+H2O(l); △H=-11.46 kJ/mol
- B.2KOH(aq)+ H2SO4(aq)==K2SO4(aq)+2H2O(g);△H=-114.6 kJ/mol
- C.2KOH(aq)+ H2SO4(aq)==K2SO4(aq)+2H2O(l);△H=+114.6 kJ/mol
- D.KOH(aq)+1/2H2SO4(aq)==1/2K2SO4(aq)+H2O(l);△H=-57.3 kJ/mol
D
考查中和热的概念和热化学方程式的书写。中和热是指在一定条件下的稀溶液中,酸和碱反应生成1mol水时放出的热量,即中和反应一定是放热反应。11.2g KOH是0.2mol,1L 0.12mol/L的H2SO4是0.12mol,所以反应中可生成0.2mol水,因此中和热是11.46×5=57.3 kJ/mol,答案选D。
考查中和热的概念和热化学方程式的书写。中和热是指在一定条件下的稀溶液中,酸和碱反应生成1mol水时放出的热量,即中和反应一定是放热反应。11.2g KOH是0.2mol,1L 0.12mol/L的H2SO4是0.12mol,所以反应中可生成0.2mol水,因此中和热是11.46×5=57.3 kJ/mol,答案选D。

练习册系列答案
相关题目
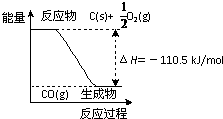 反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )
反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )