题目内容
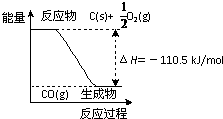 反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )
反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )分析:A.碳完全燃烧放出的热量比不完全燃烧多;
B.根据反应热计算;
C.△H=-221 kJ/mol;
D.△H=-57.3 kJ/mol
B.根据反应热计算;
C.△H=-221 kJ/mol;
D.△H=-57.3 kJ/mol
解答:解:A.碳完全燃烧放出的热量比不完全燃烧多,2molC反应生成CO放出221 kJ能量,则生成二氧化碳放出的热量大于221 kJ,故A正确;
B.生成14 g CO(g),为0.5mol,放出的热量为
×110.5 kJ=55.25kJ,故B错误;
C.该反应的热化学方程式是2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol;
D.KOH的物质的量为0.2mol,则n(H2SO4)=1L×0.1mol/L=0.1mol,二者恰好反应生成0.2mol水,放出11.46KJ的热量,则生成1mol水时放出的热量为57.3kJ,则表示中和热的热化学方程式2KOH (aq)+H2SO4 (aq)=K2SO4(aq)+2H2O (l)△H=-114.6 kJ/mol,故D正确.
故选AD.
B.生成14 g CO(g),为0.5mol,放出的热量为
| 1 |
| 2 |
C.该反应的热化学方程式是2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol;
D.KOH的物质的量为0.2mol,则n(H2SO4)=1L×0.1mol/L=0.1mol,二者恰好反应生成0.2mol水,放出11.46KJ的热量,则生成1mol水时放出的热量为57.3kJ,则表示中和热的热化学方程式2KOH (aq)+H2SO4 (aq)=K2SO4(aq)+2H2O (l)△H=-114.6 kJ/mol,故D正确.
故选AD.
点评:本题考查反应热与焓变,题目难度不大,注意中和热、燃烧热的区别,把握反应热的计算.

练习册系列答案
相关题目
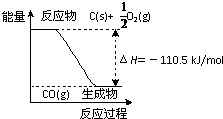 反应2C+O2=2CO 的能量变化如图所示.下列说法正确的是( )
反应2C+O2=2CO 的能量变化如图所示.下列说法正确的是( )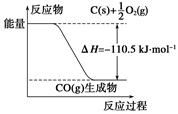
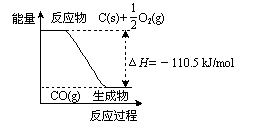 A.12 g C(s)与一定量O2(g)反应生成14 g CO(g),
A.12 g C(s)与一定量O2(g)反应生成14 g CO(g),