题目内容
有一硫酸和硝酸的混合溶液,取出其中的10mL,加入足量BaCl2溶液,将生成的沉淀滤出洗净,烘干称得其质量为9.32g;另取此溶液10mL与4.00mol?L-1的NaOH溶液25mL恰好完全中和.求:
①混合液中硫酸,硝酸的物质的量浓度分别是多少?
②将0.96g铜投入到10mL加热的混合溶液中,标况下能够生成气体多少毫升?
①混合液中硫酸,硝酸的物质的量浓度分别是多少?
②将0.96g铜投入到10mL加热的混合溶液中,标况下能够生成气体多少毫升?
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:①硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀为硫酸钡,根据n=
计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4).另取此溶液10mL与4.0mol?L-1NaOH溶液25mL恰好完全中和,H+与OH-按物质的量之比1:1反应,故n(HNO3)+2n(H2SO4)=n(NaOH),据此计算硝酸10mL溶液中硝酸的物质的量,根据c=
计算硫酸、硝酸的物质的量浓度;
②发生3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,判断反应的过量问题,根据不足量的物质计算生成NO体积.
| m |
| M |
| n |
| V |
②发生3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,判断反应的过量问题,根据不足量的物质计算生成NO体积.
解答:
解:①硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀为硫酸钡,根据硫酸根守恒故n(H2SO4)=n(BaSO4)=
=0.04mol,故原溶液中c(H2SO4)=
=4mol/L;
另取此溶液10mL与4.0mol?L-1NaOH溶液25mL恰好完全中和,H+与OH-按物质的量之比1:1反应,故n(HNO3)+2n(H2SO4)=n(NaOH),即n(HNO3)+2×0.04mol=0.025L×4mol/L,解得n(HNO3)=0.02mol,故原溶液中n(HNO3)=
=2mol/L,
答:原混合液中H2SO4的物质的量浓度为4mol/L,HNO3的物质的量浓度2mol/L.
②0.96g铜的物质的量为
=0.015mol,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,氢离子的物质的量是0.04mol×2+0.02mol=0.1mol,
3 Cu+8 H++2 NO3-=3Cu2++4H2O+2NO↑
3mol 8mol 2mol
0.015mol 0.04mol 0.01mol
所以硝酸根和氢离子是过量的,Cu不足,所以生成NO的物质的量为0.015mol×
=0.01mol,标准状况下的体积是0.01mol×22.4L/mol=0.224L.
答:标况下能生成气体体积为0.224L.
| 9.32g |
| 233g/mol |
| 0.04mol |
| 0.01L |
另取此溶液10mL与4.0mol?L-1NaOH溶液25mL恰好完全中和,H+与OH-按物质的量之比1:1反应,故n(HNO3)+2n(H2SO4)=n(NaOH),即n(HNO3)+2×0.04mol=0.025L×4mol/L,解得n(HNO3)=0.02mol,故原溶液中n(HNO3)=
| 0.02mol |
| 0.01L |
答:原混合液中H2SO4的物质的量浓度为4mol/L,HNO3的物质的量浓度2mol/L.
②0.96g铜的物质的量为
| 0.96g |
| 64g/mol |
3 Cu+8 H++2 NO3-=3Cu2++4H2O+2NO↑
3mol 8mol 2mol
0.015mol 0.04mol 0.01mol
所以硝酸根和氢离子是过量的,Cu不足,所以生成NO的物质的量为0.015mol×
| 2 |
| 3 |
答:标况下能生成气体体积为0.224L.
点评:本题考查混合物的有关计算、化学方程式有关计算,难度中等,侧重考查学生分析计算能力.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
NaCl溶液中含有可溶性的CaCl2、MgCl2、Na2SO4杂质.现欲除去杂质,得到纯净的NaCl溶液,则加入试剂的顺序不正确的是( )
| A、BaCl2→NaOH→Na2CO3→HCl |
| B、BaCl2→Na2CO3→NaOH→HCl |
| C、NaOH→BaCl2→Na2CO3→HCl |
| D、Na2CO3→BaCl2→NaOH→HCl |
下列反应从理论上分析不能将化学能转化为电能的是( )
| A、NaAlO2+4HCl=NaCl+AlCl3+2H2O |
| B、Mg+H2SO4=MgSO4+H2↑ |
| C、2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
| D、CH4+2O2=CO2+2H2O |
实验室对某有机物有如下实验记录:①在氧气中完全燃烧,只生成CO2和H2O;②完全燃烧1mol该有机物需消耗氧气112L(标准状况下).4位同学据此分别提出以下4种该有机物可能的分子式,其中合理的是( )
| A、C2H6 |
| B、C3H8O |
| C、C4H8O2 |
| D、C5H10O3 |
 营养学研究发现,从深海鱼油提取的DHA是一种不饱和高级脂肪酸(假设DHA的化学式为CxHyO2),同温同压条件下,测得DHA蒸汽的质量是同体积H2质量的192倍;将3.84g的DHA完全燃烧,并使产生的产物全部依次通过如图装置,得到下表所列的实验结果(假设产生的气体产物完全被吸收).
营养学研究发现,从深海鱼油提取的DHA是一种不饱和高级脂肪酸(假设DHA的化学式为CxHyO2),同温同压条件下,测得DHA蒸汽的质量是同体积H2质量的192倍;将3.84g的DHA完全燃烧,并使产生的产物全部依次通过如图装置,得到下表所列的实验结果(假设产生的气体产物完全被吸收). 在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来:则:
在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来:则: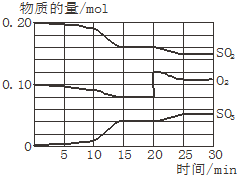 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题: