题目内容
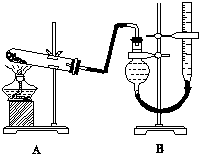
5.四氯化钛(TiCl4)是工业上制备金属钛的重要原料.常温下,它是一种极易水解(与水反应)的无色液体,沸点为136.4℃.工业制备TiCl4和钛的反应为:TiO2+2C+2Cl2$\frac{\underline{\;800℃\;}}{\;}$TiCl4+2CO; TiCl4+2Mg $\frac{\underline{\;800℃\;}}{\;}$Ti+2MgCl2图是实验室制备TiCl4的反应装置,主要操作步骤:

①.连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②.当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水.
(1)正确的操作顺序为(填序号)③①④②.
(2)装置A中反应的离子方程式:MnO2+2Cl-+4H+$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)操作①的目的是排出装置内的空气,避免生成的TiCl4遇空气中水蒸气发生水解;
(4)D中冷凝管由b进冷水起冷凝作用,装置E的作用是吸收未完全反应的Cl2,以免污染空气;
(5)TiCl4极易与空气中的水反应,产物之一遇水形成白雾,化学方程式为:TiCl4+4H2O═4HCl+Ti(OH)4;
(6)工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$ Ti+2MgCl2,氩气的作用为防止Mg和Ti被空气中氧气氧化.
分析 (1)实验时,先装入药品,然后通入二氧化碳,将容器中的水蒸气、氧气等排除,加热反应,反应完毕后,继续通入二氧化碳,将装置内的氯气、CO等排出;
(2)装置A中用于制备氯气,反应加热,应为二氧化锰和浓盐酸的反应;
(3)四氯化钛极易水解,能与装置中的空气里的水蒸气反应;
(4)反应中有未反应的氯气及挥发出来的氯化氢,会污染空气,所以要用氢氧化钠溶液进行尾气吸收;
(5)TiCl4极易与空气中的水反应,产物之一遇水形成白雾,说明发生化学反应生成Ti(OH)4和氯化氢气体;
(6)在800℃高温和氩气氛围中还原TiCl4的方法制备钛,目的是为了防止金属被空气中的氧气氧化.
解答 解:(1)实验时,先装入药品,然后通入二氧化碳,将容器中的水蒸气、氧气等排除,加热反应,反应完毕后,继续通入二氧化碳,将装置内的氯气、CO等排出,操作顺序为③①④②,
故答案为:③①④②;
(2)装置A中用于制备氯气,反应加热,应为二氧化锰和浓盐酸的反应,反应的离子方程式为MnO2+4H++2 Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)四氯化钛极易水解,能与装置中的空气里的水蒸气反应,所以在通Cl2前先通入CO2气体并持续一段时间,排尽装置中的空气,避免TiCl4 遇空气中水蒸气发生水解,
故答案为:排尽装置内的空气,避免TiCl4 遇空气中水蒸气发生水解;
(4)反应中有未反应的氯气及挥发出来的氯化氢,会污染空气,所以要用氢氧化钠溶液进行尾气吸收,所以E的作用是吸收多余的Cl2及挥发的HCl,以免污染空气,
故答案为:吸收多余的Cl2及挥发的HCl,以免污染空气.
(5)TiCl4极易与空气中的水反应,产物之一遇水形成白雾,化学方程式为:说明发生化学反应生成Ti(OH)4和氯化氢气体,反应的化学方程式为:TiCl4+4H2O═4HCl+Ti(OH)4 ,
故答案为:TiCl4+4H2O═4HCl+Ti(OH)4 ;
(6)工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛:TiCl4+2Mg$\frac{\underline{\;800℃\;}}{\;}$ Ti+2MgCl2,氩气的作用为防止Mg和Ti被空气中氧气氧化,
故答案为:防止Mg和Ti被空气中氧气氧化.
点评 本题考查物质的制备和性质探究,为高频考点,侧重于学生的分析能力和实验能力的考查,要根据实验原理提出假设,再结合物质的性质加以验证,侧重于考查学生的实验探究能力和对知识的应用能力,题目难度中等.

 在恒容密闭容器中加入一定量的反应物后发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时 CO2(g)的物质的量浓度c(CO2)与温度T的关系如
在恒容密闭容器中加入一定量的反应物后发生可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时 CO2(g)的物质的量浓度c(CO2)与温度T的关系如图所示.下列说法不正确的是( )
| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在T2 时,若反应处于状态D,则一定有v正<v逆 | |
| C. | 平衡状态A 与C 相比,平衡状态A 的c(CO)小 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
| A. | 铝箔插入稀HNO3中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| C. | 明矾可用于水的消毒,杀菌 | |
| D. | 向NaAlO2溶液中通入过量CO2的离子方程式为2AlO${\;}_{2}^{-}$+CO2+3H2O═2Al(OH)3↓+CO${\;}_{3}^{2-}$ |
 某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:(一)制取氧化铜
①称取2g CuSO4•5H2O研细后倒入烧杯,加10mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是①②③(填实验序号),步骤①③中研磨固体所用仪器的名称是研钵;
(二)证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较,相关数据如下:
| 实验序号 | KClO3质量 | 其他物质质量 | 待测数据 |
| ④ | 1.2g | 无其他物质 | |
| ⑤[ | 1.2g | CuO 0.5g | |
| ⑥ | 1.2g | MnO2 0.5g |
(2)上述实验中“待测数据”指产生25mL气体所需时间;
(3)本实验装置图中量气装置B由干燥管、乳胶管和50mL滴定管改造后组装而成,此处所用滴定管是碱式(选填“酸式”或“碱式”)滴定管;读数时需要注意①上下移动右管使两液面相平; ②视线与刻度线相平
(4)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.检测CuO反应前后质量是否改变,
b.CuO的化学性质有没有改变.
| A. | 10 mol | B. | 11 mol | C. | 12 mol | D. | 13 mol |
 3,3,5,5-四甲基庚烷;
3,3,5,5-四甲基庚烷; ;
; .
. 聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如图:
聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如图: