题目内容
在一定条件下,SO2和O2发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0
(1)将0.10molSO2(g)和0.060molO2(g)放入容积为2L的恒容密闭容器中,反应在一定条件下达到平衡,测得c(SO3)=0.040mol/L.计算该条件下反应的平衡常数K和SO2的平衡转化率(把计算过程写在答卷上).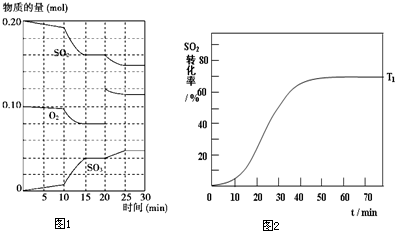
(2)600℃时,在一密闭容器中,将SO2和O2混合,反应过程中SO2、O2、SO3物质的量变化如图1所示,反应处于平衡状态的时间是 .
(3)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号).
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
(4)SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,在图2中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图.
(1)将0.10molSO2(g)和0.060molO2(g)放入容积为2L的恒容密闭容器中,反应在一定条件下达到平衡,测得c(SO3)=0.040mol/L.计算该条件下反应的平衡常数K和SO2的平衡转化率(把计算过程写在答卷上).

(2)600℃时,在一密闭容器中,将SO2和O2混合,反应过程中SO2、O2、SO3物质的量变化如图1所示,反应处于平衡状态的时间是
(3)据图判断,反应进行至20min时,曲线发生变化的原因是
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
(4)SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,在图2中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图.
考点:化学平衡建立的过程,化学平衡状态的判断,物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)利用三段式,根据平衡常数和转化率的定义计算;
(2)根据平衡状态的特征判断;
(3)根据图中有关数据的变化及影响反应速率的因素作判断;
(4)根据温度对化学平衡的影响可画出图;
(2)根据平衡状态的特征判断;
(3)根据图中有关数据的变化及影响反应速率的因素作判断;
(4)根据温度对化学平衡的影响可画出图;
解答:
解:(1)利用三段式,
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始浓度(mol?L-1) 0.050 0.030 0
转化浓度(mol?L-1) 0.040 0.020 0.040
平衡浓度(mol?L-1) 0.010 0.010 0.040
所以平衡常数K=
=
=1.6×103,SO2的平衡转化率=
×100%=80%,
答:该条件下反应的平衡常数K为1.6×103;SO2的平衡转化率为80%;
(2)根据图可知,在15~20 min和25~30 min时间段里,各物质的浓度不再随时间的变化而变化,此时反应处于平衡状态,
故答案为:15~20 min和25~30 min;
(3)根据图可知,反应进行至20min时,SO2和SO3物质的量没有改变,而O2的物质的量突然增加了,所以改的条件为增加了O2的量;根据图可以看出在10min到15min的时间段里,各物质的量是在原来的基础上变化,没有增加或减少,反应向正反应方向进行,但反应速率加快了,所以改变的条件可能是曲线变化的原因可能是加了催化剂或缩小容器体积或升高温度,故选ab,故答案为:增加了O2的量;ab;
(4)由于该反应正反应是放热反应,当升高温度时,平衡逆向移动,SO2的转化率下降,但反应速率加快,据此可画出图为: 故答案为:
故答案为: ;
;
2SO2(g)+O2(g)
 2SO3(g)
2SO3(g)起始浓度(mol?L-1) 0.050 0.030 0
转化浓度(mol?L-1) 0.040 0.020 0.040
平衡浓度(mol?L-1) 0.010 0.010 0.040
所以平衡常数K=
| c2(SO3) |
| c2(SO2)?c(O2) |
| 0.042 |
| 0.012×0.01 |
| 0.04 |
| 0.05 |
答:该条件下反应的平衡常数K为1.6×103;SO2的平衡转化率为80%;
(2)根据图可知,在15~20 min和25~30 min时间段里,各物质的浓度不再随时间的变化而变化,此时反应处于平衡状态,
故答案为:15~20 min和25~30 min;
(3)根据图可知,反应进行至20min时,SO2和SO3物质的量没有改变,而O2的物质的量突然增加了,所以改的条件为增加了O2的量;根据图可以看出在10min到15min的时间段里,各物质的量是在原来的基础上变化,没有增加或减少,反应向正反应方向进行,但反应速率加快了,所以改变的条件可能是曲线变化的原因可能是加了催化剂或缩小容器体积或升高温度,故选ab,故答案为:增加了O2的量;ab;
(4)由于该反应正反应是放热反应,当升高温度时,平衡逆向移动,SO2的转化率下降,但反应速率加快,据此可画出图为:
 故答案为:
故答案为: ;
;
点评:本题主要考查了平衡常数的计算和转化率的计算以及影响反应速率和平衡移动的因素等知识点,中等难度,解题的关键在于对图象的分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列变化不能说明发生了化学变化的是( )
| A、变化时有电子的得失或共用电子对的偏移 |
| B、变化过程中有旧化学键的断裂和新化学键的形成 |
| C、变化时释放出能量 |
| D、变化前后原子的种类和数目没有改变,分子种类增加了 |
油脂皂化反应后使肥皂和甘油充分分离,这种分离方法及该方法属于( )
| A、盐析 化学变化 |
| B、萃取 物理变化 |
| C、盐析 物理变化 |
| D、蒸馏 物理变化 |
现有常温下的四份溶液:①0.01mol/L CH3COOH;②0.01mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是( )
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大 |
| C、将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
| D、将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
 M是一种治疗艾滋病的新药(结构简式如图所示),已知M分子中-NH-COO-基团(除H外)与苯环在同一平面内,关于M的以下说法正确的是( )
M是一种治疗艾滋病的新药(结构简式如图所示),已知M分子中-NH-COO-基团(除H外)与苯环在同一平面内,关于M的以下说法正确的是( )| A、该物质易溶于水 |
| B、M能发生加聚反应 |
| C、M的分子式为C13H12O2NF4 |
| D、M分子内有15个原子在同一个平面上 |
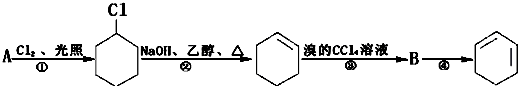
 具有的性质叙述正确的是
具有的性质叙述正确的是