题目内容
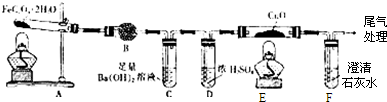
Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4?5H2O的流程图:
Cu2S
Cu
Cu2O、CuO
A
B
胆矾
(1)Cu2S中铜元素的化合价为 ,火法炼铜的反应原理是(用化学方程式表示) .
(2)若将A中红色物质反应掉,操做Ⅰ加入试剂最好是 .
A.加入适量的NaNO3 B.适量的 HNO3 C.适量的H2O2
(3)取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如图所示:通过计算确定258℃时发生反应的化学方程式: ,e点物质的化学式 (计算过程略去).

Cu2S
| O2 |
| △ |
| 焙烧 |
| 足量稀硫酸 |
| 操作Ⅰ |
| 蒸发结晶过滤 |
(1)Cu2S中铜元素的化合价为
(2)若将A中红色物质反应掉,操做Ⅰ加入试剂最好是
A.加入适量的NaNO3 B.适量的 HNO3 C.适量的H2O2
(3)取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如图所示:通过计算确定258℃时发生反应的化学方程式:

考点:铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:(1)化合物中各元素化合价的代数和为0;依据流程中Cu2S与O2反应得到Cu写出方程式即可;
(2)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质;
(3)根据减少的质量确定b、c段固体的化学式,从而确定发生的反应.
(2)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质;
(3)根据减少的质量确定b、c段固体的化学式,从而确定发生的反应.
解答:
解:(1)化合物中各元素化合价代数和为0,O元素的化合价为-2价,所以Cu元素的化合价为+1价;Cu2S与O2反应得到Cu,Cu的化合价降低,故S的化合价升高,反应为:2Cu2S+3O2
2Cu+SO2,故答案为:+1;2Cu2S+3O2
22Cu+SO2;
(2)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质,硝酸具有强氧化性但引进杂质离子,氢氧化钠没有氧化性且能引进杂质离子,双氧水具有强氧化性且不引进杂质离子,故选C,故答案为:C;
(3)硫酸铜的物质的量=
=0.02mol,根据胆矾的化学式知,结晶水的质量=0.02mol×5×18g/mol=1.8g,当固体质量减少1.8g时胆矾完全分解,258℃时,固体减少的质量=5.00g-3.20g=1.80g,所以C段固体是硫酸铜,b段物质减少的质量=5.00g-3.56g=1.44g,则失去的水的物质的量=
=0.08mol,则固体中剩下水的物质的量为0.02mol×5-0.08mol=0.02mol,则b段固体的化学式为CuSO4.H2O,该反应方程式为CuSO4.H2O
CuSO4+H2O;
e点时固体质量为1.44g,铜的质量=0.02mol×64g/mol=1.28g,则另一种元素质量为1.44g-1.28g=0.16g,如果另一种元素是S元素,则硫的物质的量为
=0.005mol,铜原子的物质的量为0.02mol,则Cu和S的个数比为4:1,不符合化合价原则,所以另一种元素是氧元素,其物质的量为
=0.01mol,所以其化学式为Cu2O,
故答案为:CuSO4.H2O
CuSO4+H2O;Cu2O.
| ||
| ||
(2)溶解时要加入氧化剂使铜被氧化,且不能引进新的杂质,硝酸具有强氧化性但引进杂质离子,氢氧化钠没有氧化性且能引进杂质离子,双氧水具有强氧化性且不引进杂质离子,故选C,故答案为:C;
(3)硫酸铜的物质的量=
| 5.00g |
| 25.0g/mol |
| 1.44g |
| 18g/mol |
| ||
e点时固体质量为1.44g,铜的质量=0.02mol×64g/mol=1.28g,则另一种元素质量为1.44g-1.28g=0.16g,如果另一种元素是S元素,则硫的物质的量为
| 0.16g |
| 32g/mol |
| 0.16g |
| 16g/mol |
故答案为:CuSO4.H2O
| ||
点评:本题考查了物质的量的有关计算,结合元素化合价变化及氧化还原反应来分析解答,难点是(3)题,根据固体质量变化确定每一段物质的组成,从而确定每一段发生的反应,难度中等.

练习册系列答案
相关题目
化学变化不能实现的是( )
①一种核素变成另一种核素
②一种离子变成另一种离子
③一种分子变成另一种分子
④一种单质变成另一种单质
⑤一个质子变成一个中子
⑥一种同素异形体变成另一种同素异形体
⑦混合物变成纯净物
⑧有毒、有污染的物质转化成无毒、无污染的物质
⑨金属元素变成非金属元素
⑩共价化合物转化成离子化合物.
①一种核素变成另一种核素
②一种离子变成另一种离子
③一种分子变成另一种分子
④一种单质变成另一种单质
⑤一个质子变成一个中子
⑥一种同素异形体变成另一种同素异形体
⑦混合物变成纯净物
⑧有毒、有污染的物质转化成无毒、无污染的物质
⑨金属元素变成非金属元素
⑩共价化合物转化成离子化合物.
| A、①②④⑤⑦ | B、②③⑥⑧ |
| C、①⑤⑨ | D、③⑥⑨⑩ |
25℃时,有关弱酸的电离平衡常数如下,下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2CO3)>pH(NaCN) |
| B、a mol?L-1HCN溶液与b mol?L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C、0.1 mol?L-1CH3COOH溶液中逐滴加入水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| D、NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
由以下两种途径制铜:
(1)CuO
CuSO4
Cu
(2)Zn
H2
Cu
假设每一步反应都完全,要制得等质量的铜,两个途径相比较,下列有关说法正确的是( )
(1)CuO
| H2SO4 |
| Zn |
(2)Zn
| H2SO4 |
| CuO |
假设每一步反应都完全,要制得等质量的铜,两个途径相比较,下列有关说法正确的是( )
| A、消耗等物质的量的Zn、H2SO4、CuO |
| B、所有反应类型都相同 |
| C、过程中产生的ZnSO4质量相同 |
| D、只有CuO消耗的质量相同 |
下列变化中,不可能通过一步反应实现的是( )
| A、Cu→CuSO4 |
| B、Fe→FeCl3 |
| C、NH3→NO |
| D、SiO2→H2SiO3 |
设NA代表阿佛加德罗常数的数值,下列说法中正确的是( )
| A、常温常压下,17g甲基(-14CH3)所含的中子数为8NA |
| B、64g的铜发生氧化还原反应,一定失去2 NA个电子 |
| C、常温常压22.4LNO气体的分子数为NA |
| D、标况时,22.4L三氯甲烷所含有的分子数为NA |
下列陈述ⅠⅡ正确并且有因果关系的是( )


| A、A | B、B | C、C | D、D |