题目内容
 模型是研究化学的一种方法,例如原子结构示意图、电子式、分子结构模型等,可以帮助我们开启化学思维.
模型是研究化学的一种方法,例如原子结构示意图、电子式、分子结构模型等,可以帮助我们开启化学思维.(1)原子结构示意图可以象征性地表示原子结构,请画出氯原子的原子结构示意图:
(2)电子式可直观地表示物质的形成过程.请用电子式表示NaCl的形成过程:
(3)右图是两种常见的有机物分子结构模型,回答有关问题:
①甲所代表的物质空间构型是.
②乙所代表的物质中碳碳键的特点是:
③在化学学习中,你还学习哪些化学模型
考点:球棍模型与比例模型,电子式,原子结构示意图,有机化合物中碳的成键特征
专题:化学用语专题
分析:(1)氯的原子序数为17,位于周期表中第三周期、第ⅧA族,根据电子层数等于周期序数,结合次处层电子数和最外层电子数就能确定原子结构示意图;
(2)氯化钠属于离子化合物,根据Na和Cl原子的电子式书写形成过程;
(3)①甲中心原子的周围有四个完全一样的原子,键长和键角完全一样,为正四面体结构;
②乙为苯的结构,苯中的碳碳键完全相同,是一种介于单键和双键之间的独特的键;
③化学中,常见的化学模型有:原子结构示意图、电子式、分子结构模型、结构式、结构简式等;
(2)氯化钠属于离子化合物,根据Na和Cl原子的电子式书写形成过程;
(3)①甲中心原子的周围有四个完全一样的原子,键长和键角完全一样,为正四面体结构;
②乙为苯的结构,苯中的碳碳键完全相同,是一种介于单键和双键之间的独特的键;
③化学中,常见的化学模型有:原子结构示意图、电子式、分子结构模型、结构式、结构简式等;
解答:
解:(1)氯的原子序数为17,根据电子层数等于周期序数,结合次处层电子数和最外层电子数就能确定原子结构示意图为: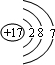 故答案为:
故答案为: ;
;
(2)氯化钠属于离子化合物,反应中Na失去电子,Cl得到电子,根据Na和Cl原子的电子式: 故答案为:
故答案为: ;
;
(3)①甲中心原子的周围有四个完全一样的原子,键长和键角完全一样,为正四面体结构,故答案为:正四面体型;
②乙为苯的结构,苯中的碳碳键完全相同,是一种介于单键和双键之间的独特的键,故答案为:六个碳原子之间的键完全相同,是一种介于单键和双键之间的独特的键;
③化学中,常见的化学模型有:原子结构示意图、电子式、分子结构模型、结构式、结构简式等,故答案为:结构式(或结构简式、化学方程式、离子方程式等)(合理均可给分).
 故答案为:
故答案为: ;
;(2)氯化钠属于离子化合物,反应中Na失去电子,Cl得到电子,根据Na和Cl原子的电子式:
 故答案为:
故答案为: ;
;(3)①甲中心原子的周围有四个完全一样的原子,键长和键角完全一样,为正四面体结构,故答案为:正四面体型;
②乙为苯的结构,苯中的碳碳键完全相同,是一种介于单键和双键之间的独特的键,故答案为:六个碳原子之间的键完全相同,是一种介于单键和双键之间的独特的键;
③化学中,常见的化学模型有:原子结构示意图、电子式、分子结构模型、结构式、结构简式等,故答案为:结构式(或结构简式、化学方程式、离子方程式等)(合理均可给分).
点评:本题考查化学用语,题目较为简单,注意化学用语和化学方法的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式的书写正确的是( )
| A、实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B、实验室用二氧化锰和浓盐酸制取Cl2:MnO2+4HCl(浓)=Mn2++Cl2↑+2H2O+2C1- |
| C、C12与NaOH溶液反应:Cl2+2OH-=C1-+C1O-+H2O |
| D、实验室用硅酸钠溶液和稀盐酸制取硅酸胶体:2H++SiO32-=H2SiO3↓ |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、标准状况下,22.4L二氯甲烷的分子数约为NA个 |
| B、1molNa2O2固体中含离子总数为3NA |
| C、1mol/LCuCl2溶液中含有Cl-的个数为2NA |
| D、电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g |
下列各组中的离子,能在溶液中大量共存的是( )
| A、H+、Na+、CO32-、Cl- |
| B、Ba2+、Na+、Cl-、SO42- |
| C、Ag+、Al3+、NO3-、H+ |
| D、K+、H+、SO42-、OH- |