题目内容
下列描述违背化学原理的是( )
| A、碳酸钠溶液显碱性,硫酸钠溶液显中性,可判断硫与碳的非金属活动性强弱 |
| B、相同温度时,取物质的量浓度相同的盐酸和乙酸分别滴在PH试纸上,可判断两者酸性强弱 |
| C、NH4Cl溶于重水(D2O)中,反应生成的一水合氨和水合氢离子分别为NH3?HDO和等D3O+ |
| D、高温时C能置换出SiO2中的Si,说明还原性C比Si强 |
考点:非金属在元素周期表中的位置及其性质递变的规律,盐类水解的原理
专题:元素周期律与元素周期表专题,化学应用
分析:A、碳酸钠是弱酸强碱盐溶液显碱性,硫酸钠是强酸强碱盐溶液显中性,碳酸是弱酸,硫酸是强酸,都是最高价氧化物对应的水化物;
B、在温度和浓度相同的情况下,一元酸可以用PH试纸,来判断两者酸性强弱;
C、盐水解的实质是盐电离出的弱离子结合水电离出的氢离子和氢氧根离子形成弱电解质的过程;
D、该反应是在高温条件下进行的反应,不是在常温.
B、在温度和浓度相同的情况下,一元酸可以用PH试纸,来判断两者酸性强弱;
C、盐水解的实质是盐电离出的弱离子结合水电离出的氢离子和氢氧根离子形成弱电解质的过程;
D、该反应是在高温条件下进行的反应,不是在常温.
解答:
解:A、碳酸钠是弱酸强碱盐溶液显碱性,硫酸钠是强酸强碱盐溶液显中性,碳酸是弱酸,硫酸是强酸,都是最高价氧化物对应的水化物,所以可判断硫与碳的非金属活动性强弱,故A正确;
B、在温度和浓度相同的情况下,一元酸可以用PH试纸,来判断两者酸性强弱,故B正确;
C、盐水解的实质是盐电离出的弱离子结合水电离出的氢离子和氢氧根离子形成弱电解质的过程,相反相成,故C正确;
D、该反应是在高温条件下进行的反应,不是在常温,高温条件得以进行,是因为生成的气体一氧化碳,脱离体系,平衡正向移动,故D错误;
故选D.
B、在温度和浓度相同的情况下,一元酸可以用PH试纸,来判断两者酸性强弱,故B正确;
C、盐水解的实质是盐电离出的弱离子结合水电离出的氢离子和氢氧根离子形成弱电解质的过程,相反相成,故C正确;
D、该反应是在高温条件下进行的反应,不是在常温,高温条件得以进行,是因为生成的气体一氧化碳,脱离体系,平衡正向移动,故D错误;
故选D.
点评:本题考查了物质之间的反应,明确反应原理是解本题关键,根据物质的性质来分析解答,易错选项是D,注意条件的特殊性,为易错点.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列有关物质结构的表述正确的是( )
A、次氯酸的电子式  |
| B、二氧化硅的分子式 SiO2 |
| C、铁原子的最外层电子数有2个 |
D、钠离子的结构示意图 |
下列各对物质间的反应既属于氧化还原反应,又属于离子反应的是( )
| A、Zn+H2SO4(稀) |
| B、NaCl+AgNO3(溶液) |
| C、H2+O2 |
| D、Na2O+H2O |
下列有关金属的描述,正确的是( )
| A、Cu和S在加热的条件下反应可生成CuS |
| B、金属铁和铝都可以被浓硫酸钝化,因此铁和铝都不能与浓硫酸反应 |
| C、等质量的金属铝,分别和足量的稀硫酸和氢氧化钠溶液反应,所得氢气一样多 |
| D、除去镀在铝表面的铜镀层,最佳试剂是稀硝酸 |
有一种气体的质量是14.2g,物质的量是0.2mol,该气体的摩尔质量是( )
| A、28.4 |
| B、28.4g?mol-1 |
| C、71 |
| D、71g?mol-1 |
下列有关化学用语表示正确的是( )
A、钾离子结构示意图: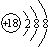 | ||
| B、乙醇的分子式:CH3CH2OH | ||
C、水合氢离子电子式: | ||
D、中子数为18的硫原子:
|
某溶液溶质的质量分数为w%,物质的量浓度为 c mol/L,密度为d g/cm3,此溶液中溶质的摩尔质量(g/mol )为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 有机物A是一种重要化工生产的中间体,其结构简式为:
有机物A是一种重要化工生产的中间体,其结构简式为: