题目内容
19.下列物质中含分子数最多的是( )| A. | 标准状况下134.4L N2 | B. | 66g CO2 | ||
| C. | 标准状况下90g H2O | D. | 6.02×1024个H2 |
分析 标准状况下1mol的任何气体的体积是22.4L,结合公式n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$解答.
解答 解:A、标准状况下134.4LN2所含有的分子个数是:$\frac{134.4L}{22.4L/mol}$×NA=6NA;
B、66g CO2所含有的分子个数为:$\frac{66}{44}$×NA=1.5NA;
C、标准状况下90 g水是液体,不是气体,物质的量为:$\frac{90g}{18g/mol}$=5 mol;即含分子数5NA;
D、6.02×1024个氢分子就是10 NA;
故D选项所含有的分子个数最多,
故选:D.
点评 本题考查了物质的量与阿伏伽德罗常数的关系,完成此题,可以依据已有的公式进行计算即可.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
10.下列事实一定能说明HF是弱酸的是( )
①1mol/L的HF水溶液能使紫色石蕊试液变红
②HF水溶液中存在HF分子
③稀释HF溶液时PH增大
④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶.
①1mol/L的HF水溶液能使紫色石蕊试液变红
②HF水溶液中存在HF分子
③稀释HF溶液时PH增大
④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体
⑥HF与水能以任意比混溶.
| A. | ①② | B. | ③⑤ | C. | ④⑥ | D. | ②④ |
7.下列关于水的说法错误的是( )
| A. | 蒸馏法是海水淡化的方法之一 | |
| B. | 长期饮用纯净水,可能会引起一些微量元素的缺乏 | |
| C. | 含有细菌的水可以用臭氧杀菌 | |
| D. | 含有重金属离子的废水用可以用明矾处理 |
4.在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A. | v(NH3)=0.1 mol/(L•min) | B. | v(NH3)=0.2 mol/(L•min) | ||
| C. | v(H2)=0.3 mol/(L•min) | D. | v(H2)=0.4 mol/(L•min) |
11.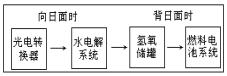 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可能循环的 | |
| B. | 燃料电池系统产生的能量实际上来自于水 | |
| C. | 水电解系统中的阳极有O2放出 | |
| D. | 燃料电池放电时的负极反应:H2+2OH--2e-=2H2O |
8.某白色粉末由两种物质组成,为鉴别其组成进行如下实验:①取少量样品加入适量蒸馏水得到澄清溶液;②向①所得的溶液中逐滴加入适量稀硫酸后出现浑浊.该白色粉末不可能是( )
| A. | Al2(SO4)3、NaOH | B. | Al2(NH3)2OH、KOH | C. | BaCl2、NaHCO3 | D. | Ca(ClO)2、NaHSO3 |
12.甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙十丁→沉淀;乙+丁→无色无味气体.则甲、乙、丙、丁四种溶液依次是( )
| A. | BaCl2、Na2CO3、盐酸、AgNO3 | B. | Na2CO3、盐酸、AgNO3、BaCl2 | ||
| C. | BaCl2、Na2CO3、AgNO3、盐酸 | D. | AgNO3、盐酸、BaCl2、Na2CO3 |
 A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).