题目内容
 (1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=
(1)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH=(2)向pH=6的蒸馏水和c(H+)=10-6mol?L-1的稀盐酸中分别投入大小、质量相同的金属钠,反应刚开始时,产生H2的速率前者与后者相比是
A、一样快 B、前者快 C、后者快 D、无法比较
(3)用惰性电极电解NaCl与NaHCO3混合液,测得溶液pH变化如图所示
①在0→t1时间内,两个电极上的电极反应式为:阳极
②用离子方程式表明0→t1时间内,溶液pH升高比较缓慢的原因:
考点:pH的简单计算,化学反应速率的影响因素,电解原理
专题:基本概念与基本理论
分析:(1)先计算溶液中氢氧化钠的物质的量浓度,再计算溶液的pH;
(2)蒸馏水与稀盐酸中氢离子浓度相同,则蒸馏水的温度一定高于稀盐酸,根据温度对反应速率的影响进行判断;
(3)用惰性电极电解混合溶液时,分两段进行,第一段:相当于电解氯化钠溶液,阳极上氯离子放电,阴极上氢离子放电,同时生成氢氧化钠,氢氧化钠和碳酸氢钠反应生成碳酸钠和水,当氯离子完全析出后,发生第二段电解,第二段电解:相当于电解碳酸氢钠和碳酸钠的混合液,阳极上氢氧根离子放电,阴极上氢离子放电,实际上相当于电解水.
(2)蒸馏水与稀盐酸中氢离子浓度相同,则蒸馏水的温度一定高于稀盐酸,根据温度对反应速率的影响进行判断;
(3)用惰性电极电解混合溶液时,分两段进行,第一段:相当于电解氯化钠溶液,阳极上氯离子放电,阴极上氢离子放电,同时生成氢氧化钠,氢氧化钠和碳酸氢钠反应生成碳酸钠和水,当氯离子完全析出后,发生第二段电解,第二段电解:相当于电解碳酸氢钠和碳酸钠的混合液,阳极上氢氧根离子放电,阴极上氢离子放电,实际上相当于电解水.
解答:
解:(1)恒温下,pH=6的蒸馏水中KW=c(H+)=c(OH-)=(10-6)2=10-12,2.3g金属钠的物质的量=
=0.1mol,c(OH-)=c(NaOH)=
=0.1mol/L,pH=6的蒸馏水中水的离子积为:10-12mol,溶液中氢离子浓度为:c(H+)=
=10-11mol/L,
所以溶液的pH=11,
故答案为:11;
(2)向pH=6的蒸馏水和c(H+)=10-6mol?L-1的稀盐酸中分别投入大小、质量相同的金属钠,二者的氢离子浓度相同,但水为弱电解质,则蒸馏水的温度一定高于稀盐酸,才能满足氢离子浓度相等,所以反应刚开始时,产生H2的速率前者与后者相比,前者反应速率大,
故答案为:B;
(3)①用惰性电极电解混合溶液时,分两段进行,第一段:相当于电解氯化钠溶液,阳极上氯离子放电,电极反应式为2Cl--2e-═Cl2↑,阴极上氢离子放电,电极反应式为:2H++2e-═H2↑,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
②用惰性电极电解氯化钠溶液时,阳极上析出氯气,阴极上析出氢气,同时溶液中还有氢氧化钠生成,氢氧化钠和碳酸氢钠反应生成碳酸钠,离子反应方程式为OH-+HCO3-═H2O+CO32-,所以溶液pH升高比较缓慢,
故答案为:OH-+HCO3-═H2O+CO32-.
| 2.3g |
| 23g/mol |
| 0.1mol |
| 1L |
| 10-12 |
| 0.1 |
所以溶液的pH=11,
故答案为:11;
(2)向pH=6的蒸馏水和c(H+)=10-6mol?L-1的稀盐酸中分别投入大小、质量相同的金属钠,二者的氢离子浓度相同,但水为弱电解质,则蒸馏水的温度一定高于稀盐酸,才能满足氢离子浓度相等,所以反应刚开始时,产生H2的速率前者与后者相比,前者反应速率大,
故答案为:B;
(3)①用惰性电极电解混合溶液时,分两段进行,第一段:相当于电解氯化钠溶液,阳极上氯离子放电,电极反应式为2Cl--2e-═Cl2↑,阴极上氢离子放电,电极反应式为:2H++2e-═H2↑,
故答案为:2Cl--2e-═Cl2↑;2H++2e-═H2↑;
②用惰性电极电解氯化钠溶液时,阳极上析出氯气,阴极上析出氢气,同时溶液中还有氢氧化钠生成,氢氧化钠和碳酸氢钠反应生成碳酸钠,离子反应方程式为OH-+HCO3-═H2O+CO32-,所以溶液pH升高比较缓慢,
故答案为:OH-+HCO3-═H2O+CO32-.
点评:本题考查电解原理、溶液pH的计算、化学反应速率的影响因素,题目难度中等,明确该温度下水的离子积常数是解本题关键,要求学生学会分析图象中出现拐点的原因.

练习册系列答案
相关题目
下列有关实验原理或操作的说法正确的是( )
| A、为得到较大的晶体颗粒,结晶时通常采用浓度较低,溶剂蒸发速度较慢或溶液冷却较慢的条件 |
| B、纸层析中,滤纸作为固定相,展开剂作为流动相 |
| C、过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 |
| D、用硝酸银溶液可以鉴别NaCl溶液和NaNO2溶液 |
如图是回收利用H2S的工艺流程.下列说法不正确的是( )

| A、反应①的离子方程式:2Fe3++H2S═2Fe2++S↓+2H+ | ||||
| B、反应②中的阴极反应式为:2H++2e-═H2↑ | ||||
C、该流程的总反应式为:H2S
| ||||
| D、该过程中,能量转化形式有两种 |
 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是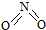 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的平均键能为466kJ?mol-1,N2O4中氮氧键的平均键能为438.5kJ?mol-1.
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的平均键能为466kJ?mol-1,N2O4中氮氧键的平均键能为438.5kJ?mol-1. 某同学用如图所示的装置研究不同电解质溶液中Mg和Al的活泼性.请回答下列问题:
某同学用如图所示的装置研究不同电解质溶液中Mg和Al的活泼性.请回答下列问题: 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D 三种物质.
,它可通过不同化学反应分别制得B、C和D 三种物质.