题目内容
7.下列各装置,能构成原电池的是( )| A. |  | B. |  | C. |  | D. |  |
分析 原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,据此分析解答.
解答 解:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,
A.该装置不能构成闭合回路,所以不能形成原电池,故A错误;
B.酒精为非电解质,该装置不能自发的进行氧化还原反应,所以不能形成原电池,故B错误;
C.该装置中锌失电子作负极,氢离子得电子在正极上反应,符合原电池的构成条件,所以能形成原电池,故C正确;
D.该装置不能构成闭合回路,酒精又是非电解质,所以不能形成原电池,故D错误;
故选C.
点评 本题考查了原电池原理,明确原电池的构成条件是解本题关键,根据原电池的构成条件来分析解答即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有关说法正确的是( )
| A. | 加热坩埚中的硫酸铜晶体,失水后须在干燥器中冷却,再称量 | |
| B. | 检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热 | |
| C. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 | |
| D. | 做锌铜稀硫酸原电池实验时,反应一段时间后锌片表面还是呈银白色 |
2.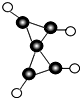 科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
 科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种化合物X,此分子的模型如图所示,其中黑圆代表碳原子,白圆代表氢原子,下列说法中不正确的是( )| A. | 该分子的分子式C5H4 | |
| B. | 1mol该物质完全燃烧生成CO2与H2O时需耗6 mol O2 | |
| C. | 该物质完全燃烧生成的CO2与H2O的分子数比为5:4 | |
| D. | 1mol该物质完全燃烧生成CO2与H2O时转移电子数为24 NA |
12.下列反应中氯元素全部被还原的是( )
| A. | 5Cl2+I2+6H2O=10HCl+2HIO3 | |
| B. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | |
| C. | MnO2+4HCl=MnCl2+2H2O+Cl2↑ | |
| D. | 2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ 2NaOH+Cl2↑+H2↑ |
19.下列检验或实验操作正确的是( )
| A. | 只用蒸馏水无法鉴别一瓶无色液体是苯还是水 | |
| B. | 碘的苯溶液呈紫色,可用蒸馏法将其进一步分离 | |
| C. | 蒸发完成时,用手直接取下蒸发皿放在石棉网上 | |
| D. | 已知汽油是无色液体,不溶于水,密度小于水,分离水和汽油的最合理方法为蒸馏 |
16.某混合气体可能含有N2、HCl、CO,依次进行如下处理,(假定每次处理均完全)( )
(1)通过足量的碳酸氢钠溶液和灼热的氧化铜,气体体积都没有变化;
(2)通过足量的过氧化钠固体,气体体积减小;
(3)通过灼热的铜网,经充分反应后气体体积又减小,但还剩余气体,由此可以确定原混合气体中.
(1)通过足量的碳酸氢钠溶液和灼热的氧化铜,气体体积都没有变化;
(2)通过足量的过氧化钠固体,气体体积减小;
(3)通过灼热的铜网,经充分反应后气体体积又减小,但还剩余气体,由此可以确定原混合气体中.
| A. | 一定没有N2,HCl 和CO中至少有一种 | |
| B. | 一定有N2,HCl 和CO | |
| C. | 一定有N2HCl 和CO中至少有一种 | |
| D. | 一定有N2 和HCl,没有CO |
 →
→ .
.