��Ŀ����
1��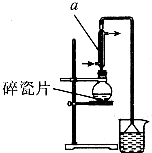 ������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�����Ʊ�1һ�嶡��ķ�Ӧ��ʵ��װ�����£�
������±�ᷴӦ���Ʊ�±��������Ҫ������ʵ�����Ʊ�1һ�嶡��ķ�Ӧ��ʵ��װ�����£�NaBr+H2SO4$\frac{\underline{\;��\;}}{\;}$HBr+NaHSO4��
C4H9-OH+HBr$\stackrel{��}{��}$ C4H9-Br+H2O��
���ܴ��ڵĸ���Ӧ�У�����Ũ����Ĵ�������ˮ����ϩ���ѣ�Br-��Ũ��������ΪBr2�ȣ�
�й������б����£�
| �۵�/�� | �е�/�� | �ܶ�/g•cm-3 | |
| ������ | -89.53 | 117.25 | 0.81 |
| 1-�嶡�� | -112.4 | 101.6 | 1.28 |
��2���Ʊ������У������Ũ�����������ʵ�ϡ�ͣ���Ŀ����abc������ĸ��ţ���
a�����ٸ�����ϩ���ѵ����� b������Br2������
c������HBr�Ļӷ� d��ˮ�Ƿ�Ӧ�Ĵ���
��3����Ӧ��������Ӧ�������1-�嶡����������Ӧ��ȡ��������õ��ϴ���1-�嶡�飬����װ�ó����õ������ܡ��¶ȼơ�ţ�ǹܡ���ƿ������Ҫ�IJ��������Ǿƾ��ơ�������ƿ��
��4������Ӧ������õ��Ļ���ᆳ����������õ��ϴ���1-�嶡��IJ����У����ܺ��е�������Ҫ��ˮ��
��5����1-�嶡���Ʒ���ڷ�Һ©���м�ˮ�����ã��������²㣨��ϲ㡱�����²㡱���ֲ㡱����
��6��ijʵ��С����ȡ1-�嶡��ʱ����Բ����ƿ�м���7.4g��������13.0g NaBr��������Ũ���ᣬ�����Ƶ�1һ�嶡��9.6g����1һ�嶡��IJ�����70%������2λ��Ч���֣���
���� ��1���������ṹ��֪AΪֱ�������ܣ���Ӧ����ʱ���¶Ȳ��˳���100�棬��ȡˮԡ���ȣ����Ƭ���Է�ֹ����ʱ���У��廯�⼫������ˮ��������
��2������Ũ����Ĵ�������ˮ����ϩ���ѣ�Br-��Ũ��������ΪBr2�ȣ�Ũ�������ջ���ȣ�����ʹHBr�ӷ���
��3����ȡ������õ�1-�嶡�飬����Ҫ���������ƾ��Ƽ�������ƿ��
��4����������¶ȸ���101.6�棬����117.25�棬���¶���ˮ���γ�ˮ������
��5��1-�嶡�鲻����ˮ���ܶȱ�ˮ��
��6����������������1-�嶡������۲���������=$\frac{ʵ�ʲ���}{���۲���}$��100%��
��� �⣺��1���������ṹ��֪AΪֱ�������ܣ���Ӧ����ʱ���¶Ȳ��˳���100�棬�Ϻõļ��ȷ����Dz�ȡˮԡ���ȣ��Ϻõļ��ȷ��������Ƭ���Է�ֹ����ʱ���У��廯�⼫������ˮ��װ���е���©���������ǣ�
�ʴ�Ϊ��ֱ�������ܣ�ˮԡ���ȣ���ֹ���У���ֹ�廯�⼫������ˮ��������
��2��a��Ũ�����1-������Ӧ������ȥ��Ӧ����ϩ�������Ӽ���ˮ��Ӧ�����ѣ�ϡ�ͺ��ܷ������Ʒ�Ӧ���ٸ�����ϩ���ѵ����ɣ���a��ȷ��
b��Ũ�������ǿ�������ܽ�����������Ϊ�嵥�ʣ�ϡ��Ũ������ܼ���Br2�����ɣ���b��ȷ��
c����Ӧ��Ҫ�廯���1-������Ӧ��Ũ�����ܽ���Һ�¶����ߣ�ʹ�廯��ӷ���ϡ�ͺ����HBr�Ļӷ�����c��ȷ��
d��ˮ�Dz��ﲻ�Ƿ�Ӧ�Ĵ�������d����
��ѡ��abc��
��3����ȡ������õ�1-�嶡�飬����װ�ó����õ������ܡ��¶ȼơ�ţ�ǹܡ���ƿ������Ҫ�IJ��������Ǿƾ��ơ�������ƿ��
�ʴ�Ϊ���ƾ��ơ�������ƿ��
��4����������¶ȸ���101.6�棬����117.25�棬���¶���ˮ���γ�ˮ���������ܺ��е�������Ҫ��ˮ��
�ʴ�Ϊ��ˮ��
��5��1-�嶡�鲻������ˮ�����ܶȴ���ˮ�����Խ�1-�嶡��ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã��������²㣬
�ʴ�Ϊ���²㣻
��6��7.4g�������淴Ӧ����1-�嶡������Ϊm����
C4H9-OH+HBr$\stackrel{��}{��}$ C4H9-Br+H2O
74 137
7.4g 13.7
�����Ƶ�1һ�嶡��9.6g����1-�嶡��IJ���=$\frac{9.6g}{13.7g}$��100%��70%��
�ʴ�Ϊ��70%��
���� ���⿼���л����Ʊ�ʵ�飬�漰��װ��������ķ������ۡ�ʵ�������������ԭ���ķ������ۡ����ʼ���ȣ�ע�����Ŀ��Ϣ�����ݵ�Ӧ�ã��ϺõĿ�����ѧ���������⡢���������������Ѷ��еȣ�

| A�� | NaOH+HCl�TNaCl+H2O | B�� | 2Al+Fe2O3$\frac{\underline{\;����\;}}{\;}$2Fe+Al2O3 | ||
| C�� | SO3+H2O�TH2SO4 | D�� | NH4HCO3 $\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O+CO2�� |
| A�� | ����ȼ�� | B�� | ���ȷ�Ӧ | C�� | Һ������ | D�� | ����к� |
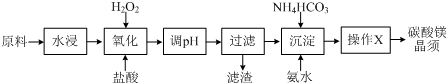
��֪��Fe3+��Fe2+��Mg2+���������������ʱ��pH
| ���� | ��ʼ���� | ������ȫ |
| Fe��OH��3 | 2.7 | 3.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| Mg��OH��2 | 9.9 | 11.1 |
��1��д���������������з��������ӷ�Ӧ����ʽ���õ����ű������ת�Ƶķ������Ŀ
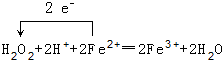 ��
����2��pH���ڵķ�Χ3.7��9.9֮�䣬��������Ҫ�ɷ�Fe��OH��3���ѧʽ����
��3������X�������ˡ�ϴ�ӡ���ɣ�֤��̼��þ�����Ѿ�ϴ�Ӹɾ��ķ���ȡ���һ��ϴ��Һ�����������ữ���ټ�����������Һ��û�а�ɫ�������ɣ�˵��ϴ�Ӹɾ���
��4��ˮ������Һ��Fe2+��Fe3+�����IJⶨ
��ȡˮ������Һ100.00mL�����Cl-��Ũ��Ϊ0.455mol•L-1�������л���ͨ������ʹFe2+ǡ����ȫת��ΪFe3+����ô�ʱ��Һ��Cl-��Ũ��Ϊ0.460mol•L-1����Һ����仯���Բ��ƣ���
����ȡˮ������Һ100.00mL�������м��������1mol•L-1NaOH��Һ����ַ�Ӧ����ˡ�ϴ�ӡ����գ���ȴ�Ƶù����ĩ������Ϊ0.96g��
��ͨ������ȷ��ˮ������Һ��Fe2+��Fe3+�����ʵ���Ũ�ȣ�д��������̣���
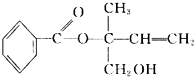
| A�� | �л���M����֬������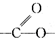 �����������Ի���������¶��ܷ���ȡ����Ӧ �����������Ի���������¶��ܷ���ȡ����Ӧ | |
| B�� | M��һ���������ܷ����Ӿ۷�Ӧ�����ܷ���������Ӧ | |
| C�� | ��Ni�������������£�1 mol M���ֻ����1molH2�ӳ� | |
| D�� | ���������Ը��������Һ���ֱ���M |
��1����֪��
C��ʯī��+$\frac{1}{2}$O2��g��=CO��g����H1=-111kJ/mol
H2��g��+$\frac{1}{2}$O2��g��=H2O��g����H2=-242kJ/mol
C��ʯī��+O2��g��=CO2��g����H3=-394kJ/mol
��д��һ����̼����ˮ����ת��Ϊ�����Ͷ�����̼��Ӧ���Ȼ�ѧ����ʽ��CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ/mol��
��2�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������ǣ�������������ţ���
A��������ѹǿ���� B�����������c��CO������
C��v����H2��=v����H2O�� D��c��CO2��=c��CO��
��3����֪һ����̼��ˮ����ת��Ϊ�����Ͷ�����̼�Ļ�ѧƽ�ⳣ�����¶ȵı仯���±���
| �¶�/�� | 400 | 500 | 800 | 1000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
��4��Ϊʹ�÷�Ӧ������������ƽ��������Ӧ�����ƶ����ɲ�ȡ�Ĵ�ʩ��A��
A������COŨ�� B�������¶�
C��������������ȥ D��ʹ�ø�Ч������
| A�� | ��ƫ��������Һ�м���������AlO2-+4H+=Al3++2H2O | |
| B�� | MnO2��Ũ�����ϼ��ȣ�MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O | |
| C�� | ��Ũ�ȵ������Ba��OH��2��Һ��NaHSO4��Һ��ϣ�Ba2++OH-+H++SO42-=BaSO4��+H2O | |
| D�� | ��NaOH��Һ��������H2S���壺OH-+H2S=HS-+H2O |
 �����̶��ϳ�H��·�����£�
�����̶��ϳ�H��·�����£�
 ��D�к��й����ŵ�����Ϊ�ʻ���ȩ����
��D�к��й����ŵ�����Ϊ�ʻ���ȩ���� +CH3OH$?_{��}^{Ũ����}$
+CH3OH$?_{��}^{Ũ����}$ +H2O��
+H2O�� ��
�� ��
�� ��
�� ��
��