题目内容
已知在稀溶液中,c(H+)?c(OH-)=KW.而溶液的PH=-lg c(H+).0℃时,1mol/L的NaOH溶液中KW=10-15,则溶液的PH值是( )
| A、0 | B、14 | C、15 | D、1 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:溶液中存在c(H+)?c(OH-)=KW,1mol/L的氢氧化钠溶液中氢氧根离子浓度为1mol/L,则c(H+)=
,据此计算出氢氧化钠溶液中氢离子浓度,再根据pH=-lg c(H+)计算出该溶液的pH.
| KW |
| c(OH-) |
解答:
解:氢氧化钠为强电解质,则1mol/L的NaOH溶液中,c(OH-)=1mol/L,
根据c(H+)?c(OH-)=KW可得:c(H+)=
=
mol/L=10-15mol/L,
该氢氧化钠溶液的pH=-lg c(H+)=-lg10-15=15,
故选C.
根据c(H+)?c(OH-)=KW可得:c(H+)=
| KW |
| c(OH-) |
| 1×10-15 |
| 1 |
该氢氧化钠溶液的pH=-lg c(H+)=-lg10-15=15,
故选C.
点评:本题考查了溶液pH的计算,题目难度不大,注意掌握水的离子积的含义,明确溶液pH的计算方法,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、硅粉不可以燃烧 |
| B、硅的性质十分稳定,所以自然界有游离态的硅 |
| C、二氧化硅既不溶于水,也不溶于任何酸 |
| D、二氧化碳通入水玻璃中可以得到硅酸 |
某酸性无色溶液中,能大量存在的离子组是( )
| A、NH4+、Cl-、Na+、Ba2+ |
| B、Na+、K+、MnO4-、NO3- |
| C、Fe2+、Na+、ClO-、Ca2+ |
| D、Na+、I-、Cl-、SiO32- |
碘化砹(AtI)可发生下列反应,①2AtI+2Mg═MgI2+MgAt2 ②AtI+2NH3(l)═NH4I+AtNH2.对上述两个反应的有关说法正确的是( )
| A、这两个反应都是氧化还原反应 |
| B、反应①中MgAt2既是氧化产物,又是还原产物 |
| C、反应②中AtI既是氧化剂,又是还原剂 |
| D、MgAt2的还原性弱于MgI2的还原性 |
下列化学反应的离子方程式正确的是( )
| A、用醋酸除去水垢:2CH3COOH+CO32-═2CH3COO-+H2O+CO2↑ |
| B、稀硝酸中加入过量的铁屑:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
| C、铝与氢氧化钠溶液反应:A1+2OH-═A1O2-+H2-↑ |
| D、等物质的量的KHSO4和Ba(OH)2的溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
在一定体积pH=2的NaHSO4溶液中,逐滴加入一定物质的量浓度的Ba(OH)2溶液,当溶液中的硫酸根恰好完全沉淀时,溶液的pH=11.若反应后溶液的体积等于反应的两溶液的体积之和,则NaHSO4溶液与Ba(OH)2溶液的体积比为( )
| A、1:9 | B、1:1 |
| C、1:2 | D、1:4 |
在溶液中可以共存,加强碱(OH-)产生沉淀,加强酸(H+)生成气体的离子组是( )
| A、Na+、Cu2+、CO32-、Cl- |
| B、HCO3-、Cl-、Na+、Mg2+ |
| C、Cl-、NO3-、K+、Ca2+ |
| D、SO42-、H+、K+、NH4+ |
下列结构式表示一种有机物的结构: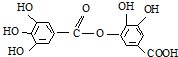 关于它的性质叙述中,正确的是( )
关于它的性质叙述中,正确的是( )
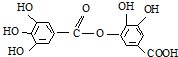 关于它的性质叙述中,正确的是( )
关于它的性质叙述中,正确的是( )| A、它有弱酸性,能与KOH反应 |
| B、可以水解生成一种生成物 |
| C、不能与强碱溶液反应 |
| D、可以水解生成两种生成物 |
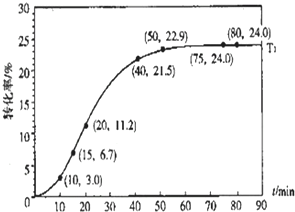 某种甲酸酯水解反应方程式为:
某种甲酸酯水解反应方程式为: