题目内容
11.下列说法正确的是( )| A. | 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀 | |
| B. | 向0.1 mol•L-1 CH3COONa溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 一定温度下,增大反应2BaO2(s)?2BaO(s)+O2(g)容器的体积,平衡不移动 | |
| D. | 反应TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)△H>0能自发进行,其原因是△S>0 |
分析 A、Cu与Fe形成原电池时,铜的金属活泼性比铁的弱,铁作负极,被腐蚀;
B、向0.1 mol•L-1 CH3COONa溶液中加入少量水,促进醋酸根的水解;
C、一定温度下,增大反应2BaO2(s)?2BaO(s)+O2(g)容器的体积即减小压强,平衡正向移动;
D、根据△G=△H-T•△S<0自发判断.
解答 解:A、Cu与Fe形成原电池时,铜的金属活泼性比铁的弱,铁作负极,被腐蚀,所以不能在海轮外壳上镶入若干铜块以减缓其腐蚀,故A错误;
B、向0.1 mol•L-1 CH3COONa溶液中加入少量水,促进醋酸根的水解,则醋酸根变少,氢离子变多,所以溶液中$\frac{c({H}^{+})}{c(C{H}_{3}CO{O}^{-})}$增大,故B错误;
C、一定温度下,增大反应2BaO2(s)?2BaO(s)+O2(g)容器的体积即减小压强,平衡正向移动,故C错误.
D、TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)在一定条件下可自发进行,则△G=△H-T•△S<0,又该反应是一个吸热反应,所以△S>0,故D正确.
故选D.
点评 本题考查了一些化学知识在生活中的应用,要根据相关知识点细心分析,注意根据△G=△H-T•△S<0判断反应自发性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.设NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 常温常压下,8.0gCH4中含有的氢原子数为NA | |
| B. | 1mol氯气跟水完全反应,转移的电子数为2NA | |
| C. | 1 molNa2O2跟足量CO2完全反应,转移的电子数为NA | |
| D. | 0.1mol/L MgCl2溶液中含氯离子数为0.2NA |
19.化学与生产、生活密切相关,下列说法不正确的是( )
| A. | 铝及其合金广泛应用,是因为铝的性质稳定,不易被腐蚀 | |
| B. | 用乙烯作为水果的催熟剂,以使生水果尽快成熟 | |
| C. | 工业上燃烧煤时,加入少量石灰石是为了减少SO2的排放 | |
| D. | 误食重金属盐引起人体中毒,可喝牛奶或豆浆解毒 |
6.下列指定反应的离子方程式正确的是( )
| A. | Na2CO3溶液中CO32-水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | Al溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3-═9Fe3++NO↑+14H2O | |
| D. | 向Ba(OH)2溶液中加少量稀H2SO4:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
16.合成药物异搏定路线中某一步骤如图:
 +
+ $\stackrel{HaH,DMF}{→}$
$\stackrel{HaH,DMF}{→}$ ,下列说法不正确的是( )
,下列说法不正确的是( )
 +
+ $\stackrel{HaH,DMF}{→}$
$\stackrel{HaH,DMF}{→}$ ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 物质X中所有碳原子可能共平面 | |
| B. | 可用FeCl3溶液鉴别Z中是否含有X | |
| C. | 等物质的量的X、Z分别与H2加成,最多消耗H2的物质的量之比为3:5 | |
| D. | 等物质的量的Y、Z分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为1:1 |
3.下列说法正确的是( )
| A. | 石油的裂解、煤的干馏、蛋白质的盐析都是化学变化 | |
| B. | C2H4Cl2、C5H12均只有两种同分异构体 | |
| C. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| D. | 已知25℃、101kPa,在稀溶液中:H+ (aq)+OH-(aq)=H2O(aq)△H=-57.3kJ/mol.则相同条件下,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量等于57.3kJ |
3.关于中和热的测得实验,下列说法正确的是( )
| A. | 为了使反应进行的更完全,可以使酸或碱适当过量 | |
| B. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| C. | 因为中和热为一定值,所以实验结果与所用酸(碱)的用量 和种类均无关 | |
| D. | 测酸溶液的温度后,未冲洗温度计就直接测碱溶液的温度,会使中和热的数值偏大 |
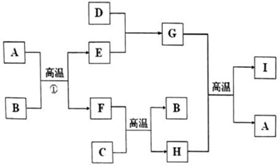 有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中.
有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. .
.