题目内容
3.下列实验目的能实现的是( )| A. |  实验室制取乙炔 | B. |  实验室制取Fe(OH)2 | ||
| C. |  实验室制取少量氨气 | D. |  实验室制取乙酸丁酯 |
分析 A.反应生成氢氧化钙易堵塞多孔隔板;
B.Fe与硫酸反应生成氢气,可排出空气,但图中不能使硫酸亚铁与NaOH反应;
C.碳酸氢铵分解生成氨气、水、二氧化碳,碱石灰可吸收水、二氧化碳;
D.乙酸丁酯的沸点124~126℃,反应温度115~125℃.
解答 解:A.反应生成氢氧化钙易堵塞多孔隔板,则不能利用图中制取气体的简易装置制备乙炔,故A错误;
B.Fe与硫酸反应生成氢气,可排出空气,但图中不能使硫酸亚铁与NaOH反应,应利用止水夹关闭左侧软管,利用氢气的压强使硫酸亚铁与NaOH接触而反应,故B错误;
C.碳酸氢铵分解生成氨气、水、二氧化碳,碱石灰可吸收水、二氧化碳,则图中装置可制备少量氨气,故C正确;
D.乙酸丁酯的沸点124~126℃,反应温度115~125℃,则不能利用图中水浴加热 装置,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备、有机物的结构与性质、实验装置等,把握物质的性质、反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,综合性较强,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验1、2、3、4按下列表格药品用量实验,并都加水稀释至10mL,假设加水后两者开始反应(下面实验同),均在室温下观察溶液颜色褪去时间,并记录如下:
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示从反应开始至颜色褪色这段时间该反应的反应速率为:
υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验1、2、3、4按下列表格药品用量实验,并都加水稀释至10mL,假设加水后两者开始反应(下面实验同),均在室温下观察溶液颜色褪去时间,并记录如下:
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,用KMnO4的浓度变化表示从反应开始至颜色褪色这段时间该反应的反应速率为:
υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | ||
| 0.6 mol/L H2C2O4溶液 | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 4 | 3.0 | 3.0 | 2.0 | t | |
14.下列物质的性质比较中正确的是( )
| A. | 键的极性:H2O>H2S | B. | 导电性:HF溶液<HCl溶液 | ||
| C. | 燃烧热:△H(C)(s,石墨)>△H(CO)(g) | D. | 耐腐蚀性:铝<生铁 |
11.美国《Science》杂志曾经报道:在40GPa高压下,用激光器加热到1800K,人们成功制得了原子晶体干冰.有关原子晶体干冰的推断错误的是( )
| A. | 有很高的熔点和沸点 | B. | 易汽化,可用作制冷材料 | ||
| C. | 含有极性共价键 | D. | 硬度大,可用作耐磨材料 |
18.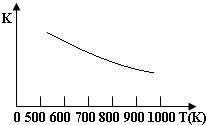 铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
 铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )| A. | H2S是还原剂 | B. | 脱除H2S的反应是放热反应 | ||
| C. | 温度越高H2S的脱除率越大 | D. | 压强越小H2S的脱除率越高 |
8.在含有0.6molCl-、0.8molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.则( )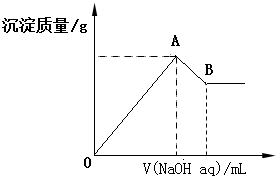

| A. | x=$\frac{2a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
15.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | CH2=CH2通入溴的四氯化碳溶液中 | 溶液褪色 | CH2=CH2发生取代反应 |
| B | KIO3溶液中加入HI溶液并加入淀粉 | 溶液变蓝色 | 氧化性:KIO3>I2 |
| C | 将盛满氯气的试管倒扣在水槽中,放在日光下静置一段时间 | 气体逐渐减少,最后变为无色 | Cl2置换出水中的氧生成了O2 |
| D | 将苯、溴水混合后加入大试管加热 | 试管底部产生油状物 | 苯发生取代反应生成溴苯 |
| A. | A | B. | B | C. | C | D. | D |
12.下列说法正确的是( )
| A. | 钠久置于空气中,可以和空气中的有关物质反应,最终生成NaHCO3 | |
| B. | 氮气的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2 | |
| C. | 海水制食盐、石油分馏、焰色反应都属于物理变化 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
13.下列说法正确的是( )
| A. | 化合物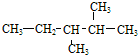 按系统命名法的名称为3,4-二甲基戊烷 按系统命名法的名称为3,4-二甲基戊烷 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 通常用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性 | |
| D. | 等质量的聚乙烯、甲烷、乙烯分别充分燃烧,所耗氧气的量依次减少 |