题目内容
12.下列说法正确的是( )| A. | 钠久置于空气中,可以和空气中的有关物质反应,最终生成NaHCO3 | |
| B. | 氮气的化学性质通常非常稳定,但在放电条件下可以与O2反应生成NO2 | |
| C. | 海水制食盐、石油分馏、焰色反应都属于物理变化 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
分析 A.金属钠可以和空气中的成分发生反应最终变为碳酸钠;
B.N2在放电条件下与O2反应只能生成NO;
C.没有新物质生成的变化属于物理变化;
D.钢铁在海水中更容易发生电化学腐蚀,加快铁的腐蚀速率.
解答 解:A.钠久置于空气中,可以和空气中的有关物质反应,最终生成Na2CO3,故A错误;
B.N2在放电条件下与O2反应只能生成NO,得不到二氧化氮,故B错误;
C.海水制食盐、石油分馏、焰色反应该过程中都没有新物质的生成,所以都属于物理变化,故C正确;
D.海水含盐量高,钢铁在海水中更容易发生电化学腐蚀,加快铁的腐蚀速率,故D错误;
故选:C.
点评 本题为综合题,涉及物质的性质、物理变化与化学变化的判断、钢铁的腐蚀,明确原电池形成条件是解题关键,题目难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
2.某学习小组的同学在学习了化学反应速率与化学平衡知识后,对反应:aA(g)+bB(g)?cC(g)+dD(g)△H,反应特点与对应的图象展开了讨论,其中不正确的是( )
| A. | 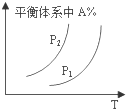 图中,若P1>P2,则该反应在较低温度下有利于自发进行 | |
| B. |  图中,若T2>T1,则△H<0且a+b=c+d | |
| C. | 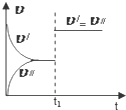 图中(v′表示正反应速率,v″表示逆反应速率),t1时刻改变的条件一定是使用了催化剂 | |
| D. | 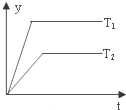 图中,若△H<0,则纵坐标不可能表示的是反应物的转化率 |
3.下列实验目的能实现的是( )
| A. |  实验室制取乙炔 | B. |  实验室制取Fe(OH)2 | ||
| C. |  实验室制取少量氨气 | D. |  实验室制取乙酸丁酯 |
20.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如图原电池,盐桥中装有饱和溶液.下列说法正确的是( )


| A. | b电极上发生还原反应 | |
| B. | 外电路电子的流向是从a到b | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O |
1.下列装置能够组成原电池的是( )
| A. |  | B. | 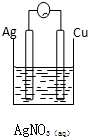 | C. | 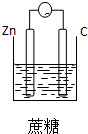 | D. | 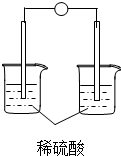 |
2.对下列事实的解释错误的是( )
| A. | 在蔗糖中加入浓H2SO4后出现发黑现象,是由于浓H2SO4具有吸水性 | |
| B. | 浓H2SO4和木炭能反应,是利用浓H2SO4的强氧化性 | |
| C. | 浓硫酸可以用于干燥Cl2,是利用浓H2SO4的吸水性 | |
| D. | 反应CuSO4+H2S=CuS↓+H2SO4能进行,说明CuS既难溶于水,也难溶于稀硫酸 |

 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +nH2O.
+nH2O. .
.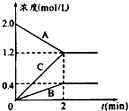 表示800℃时含有A、B、C三种气体的体系中各物质浓度(mol/L)随时间变化的情况如图所示
表示800℃时含有A、B、C三种气体的体系中各物质浓度(mol/L)随时间变化的情况如图所示

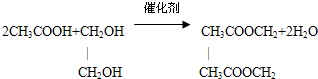 .
.