题目内容
(12分) 在实验室,可以用如图所示的装置制取乙酸乙酯。回答下列问题:
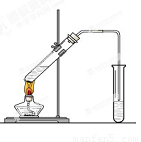
(1)右侧试管中的盛放的是 ,导气管的下端不能插入液面以下,其目的是 。
(2)写出实验室制取乙酸乙酯的化学反应方程式 ,该反应的类型是 。
(3)该反应是典型的可逆反应,若不把生成的乙酸乙酯及时蒸馏出来,反应一段时间后,就会达到化学平衡状态。下列能说明该反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水;
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸;
④正反应的速率与逆反应的速率相等;
⑤混合物中各物质的浓度不再变化。
(共12分)(1)饱和碳酸钠溶液 防止倒吸 (4分)
(2) (3分)
(3分)
酯化反应(或取代反应)(2分) (3)②④⑤(3分)
【解析】(1)由于乙酸和乙醇都是易挥发的,所以为了除去乙酸乙酯中的乙酸和乙醇,需要加入饱和碳酸钠溶液。由于乙酸和乙醇都是和水互溶的,所以为了防止倒吸,导管口不能插入液面以下。
(2)酯化反应也是取代反应,方程式为
 。
。
(3)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以④⑤正确。①③中反应速率的方向是相同的,所以不能说明。②反应速率的方向相反,且满足速率之比是相应的化学计量数之比,可以说明,所以答案选②④⑤,

 阅读快车系列答案
阅读快车系列答案(12分)在浓 CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选 填字母):a接________,________接________ ,________接h;
用A装置制取NH3的化学反应方程式为 ________________________________________
(2)用右图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用________ (选填字母编号);
| A.碱石灰 | B.生石灰 | C.无水氯化钙 | D.无水硫酸铜 E.烧碱 |
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级__________________ _________________________________________________________



