题目内容
(12分) 下图是实验室中制备气体或验证气体性质的装置图

(1)仪器a的名称是_______________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为_______________________________。
②装置B中的溶液为____________________;烧杯中溶液的作用为________________。
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有漂白性和还原性
实验2:证明碳元素的非金属性比硅元素的强
①B中为少量品红溶液,C中为少量酸性KMnO4溶液,则证明SO2具有漂白性的现象为__________。
②D中应加入足量的____________(填溶液名称),E中加入____________(填溶液名称),证明碳元素的非金属性比硅元素的强的现象为____________________________。
(1)分液漏斗 (2)①MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
②饱和食盐水 吸收多余的氯气,防止污染空气
(3)①B中品红溶液褪色
②酸性高锰酸钾溶液, 硅酸钠溶液,D中高锰酸钾溶液不褪色,E中溶液变浑浊
【解析】(1)根据a的结构可判断,a是分液漏斗。
(2)①实验室制取氯气的试剂是二氧化锰和浓盐酸,方程式为
MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
②由于浓盐酸易挥发,因此生成的氯气中含有氯化氢杂质,所以B中可以盛放饱和食盐水来除去氯化氢;由于氯气有毒,直接排放会污染空气,所以烧杯中应该盛放氢氧化钠溶液,原来吸收多余的氯气,防止污染空气。
(3)①碳在加热的条件下,能被浓硫酸氧化,生成SO2和CO2以及水。所以如果B中品红溶液褪色,则就能证明SO2具有漂白性。
②要证明碳元素的非金属性比硅元素的强,则可以利用较强的酸制取较弱的酸来实现,即将生成的CO2通入到硅酸钠溶液即可。但由于SO2也能和硅酸钠反应,所以要先除去SO2,可以利用SO2的还原性,通过酸性高锰酸钾溶液除SO2。所以D中加入的是酸性高锰酸钾溶液,用来检验SO2是否被除尽。E中加入的则是硅酸钠溶液,因此当D中高锰酸钾溶液不褪色,E中溶液变浑浊时,即能证明碳元素的非金属性比硅元素的强。

(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;
应该测定的实验数据是____________________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是____
A、硫酸钾 B、硫酸锰 C、氯化锰 D、水
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应 速率越快。 速率越快。 |
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;

应该测定的实验数据是____________________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2S
 O4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
O4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是____
| A.硫酸钾 | B.硫酸锰 | C.氯化锰 | D.水 |
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
|
实 验 步 骤 |
现 象 |
结 论 |
|
①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快。 |
(1)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;

应该测定的实验数据是____________________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是____
A、硫酸钾 B、硫酸锰 C、氯化锰 D、水
(12分) 在某个容积为2 L的密闭容器内,在T℃时按下图1所示发生反应:
 |
mA(g)+nB(g)
(1)据图1所示,反应开始至达到平衡时,用D表示该反应速率为_____;
(2)该反应的化学平衡常数K的数值为_________________(保留至两位小数);
(3) 下列措施能增大B的转化率的是
A.再投入2molA和1molB B.保持体积不变通入1molB
C.移出部分物质D D.再投入2molA、1molB和0.6molD
(4) 在T℃时,相同容器中,若开始时加入0.2 mol A 、0.8 mol B 、0.9 mol D 、0.5 mol E反应,达到平衡后,A的浓度 0.2mol/L(填“大于”、“小于”、“等于”)理由是
(5) 反应达到平衡后,第7 min时,改变条件,在第9min达到新的平衡,在图2上作出(作在答题纸上):下列情况下,D浓度变化图像
①若降低温度 (用虚线)
②若将容器的容积压缩为原来一半(用实线)

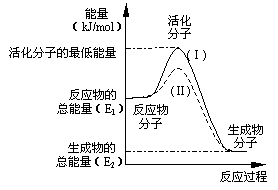 ①图中所示反应是_____________(填“吸热”
①图中所示反应是_____________(填“吸热”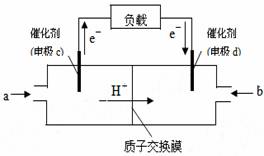 ②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。
②下图是某笔记本电脑用甲醇质子交换膜燃料电池的结构示意图。