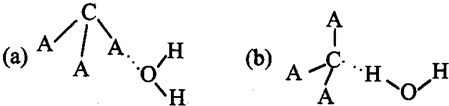题目内容
①②③④⑤⑥六种元素,在元素周期表中的位置如图所示.回答下列问题:
(1)六种元素中,金属性最强的元素位置位于元素周期表______,该元素的单质与水反应的离子方程式为______.
(2)元素①和②可以形成众多的化合物,其中最简单的是(写电子式)______,与该化合物电子总数相同的三原子分子的结构式为______.
(3)画出元素③的原子结构示意图______,该元素形成的气态氢化物通常极易溶解于水,其原因是______.
(4)写出元素④、⑥的最高价氧化物对应水化物相互反应的离子方程式为______.
| ⅠA | 0 | |||||||
| ① | ⅡA | … | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ |
(2)元素①和②可以形成众多的化合物,其中最简单的是(写电子式)______,与该化合物电子总数相同的三原子分子的结构式为______.
(3)画出元素③的原子结构示意图______,该元素形成的气态氢化物通常极易溶解于水,其原因是______.
(4)写出元素④、⑥的最高价氧化物对应水化物相互反应的离子方程式为______.
(1)周期表中,同周期元素从左到右元素的金属性逐渐减弱,同主族元素从上到下元素的金属性逐渐增强,则金属性最强的元素应为Na,位于第三周期ⅠA族,该元素的单质与水反应的离子方程式为2H2O+2Na═2Na++2OH-+H2↑,
故答案为:第三周期ⅠA族;2H2O+2Na═2Na++2OH-+H2↑;
(2)①和③可以形成众多的化合物为烃类化合物,最简单的物质为CH4,其电子式为

.与CH4电子总数相同的三原子分子是H2O,其结构式为H-O-H.
故答案为:

;H-O-H;
(3)元素③为N元素,原子核外有2个电子层,最外层电子数为5,原子结构示意图为

,该元素形成的气态氢化物为NH3,NH3是极性分子,能与水反应,与水分子能形成氢键,所以,通常极易溶解于水.
故答案为:

;NH3是极性分子,能与水反应,与水分子能形成氢键;
(4)元素④、⑥的最高价氧化物分别为NaOH、HClO4,为强碱、强酸,离子反应方程式为H++OH-═H2O,
故答案为:H++OH-═H2O.
故答案为:第三周期ⅠA族;2H2O+2Na═2Na++2OH-+H2↑;
(2)①和③可以形成众多的化合物为烃类化合物,最简单的物质为CH4,其电子式为

.与CH4电子总数相同的三原子分子是H2O,其结构式为H-O-H.
故答案为:

;H-O-H;
(3)元素③为N元素,原子核外有2个电子层,最外层电子数为5,原子结构示意图为

,该元素形成的气态氢化物为NH3,NH3是极性分子,能与水反应,与水分子能形成氢键,所以,通常极易溶解于水.
故答案为:

;NH3是极性分子,能与水反应,与水分子能形成氢键;
(4)元素④、⑥的最高价氧化物分别为NaOH、HClO4,为强碱、强酸,离子反应方程式为H++OH-═H2O,
故答案为:H++OH-═H2O.

练习册系列答案
相关题目
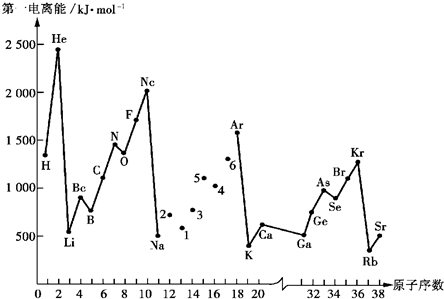

 有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物.

 【化学一一选修物质结构与性质】
【化学一一选修物质结构与性质】