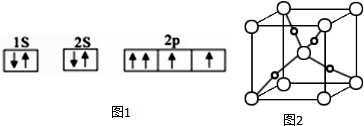
题目内容
20.下列物质的分子中,所有的原子都在同一平面上的是( )| A. | NH3 | B. | C2H6 | C. | 甲烷 | D. | 乙烯 |
分析 分子中所有的原子都在同一平面上,该分子为平面结构,氨气为三角锥形,乙烯为平面结构,甲烷为正四面体,C2H6中存在甲基,具有具有甲烷四面体结构特点.
解答 解:A.NH3为三角锥形,所有的原子不可能在同一平面上,故A不符合;
B.C2H6中存在甲基,具有具有甲烷四面体结构特点,所有的原子不可能同一平面上,故B不符合;
C.甲烷为正四面体,所有的原子不可能在同一平面上,故C不符合;
D.乙烯为平面结构,所有的原子都在同一平面上,故D符合;
故选D.
点评 本题考查分子中原子共面问题,比较基础,注意根据甲烷的正四面体、乙烯和苯的平面结构、乙炔直线形进行分析判断.

练习册系列答案
相关题目
10.表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.
请按要求回答下列问题:
(1)元素②在周期表中的位置为第二周期第IVA族
(2)④、⑤两种元素相比较,金属性强的是Na(填元素符号);
(3)这些元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(4)元素④和元素⑥形成的化合物的电子式为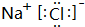 .
.
(5)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式HCl+NH3═NH4Cl.
| ① | ||||||||
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ | ||||||
(1)元素②在周期表中的位置为第二周期第IVA族
(2)④、⑤两种元素相比较,金属性强的是Na(填元素符号);
(3)这些元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(4)元素④和元素⑥形成的化合物的电子式为
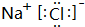 .
.(5)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式HCl+NH3═NH4Cl.
11.关于下列一组图示的说法中正确的是( )
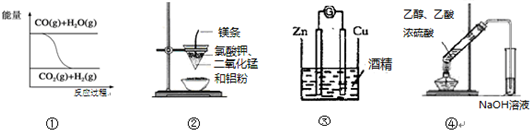

| A. | 图①表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为吸热反应 | |
| B. | 图②可以制取金属锰 | |
| C. | 图③形成原电池 | |
| D. | 图④制取乙酸乙酯 |
8.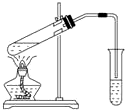 下列实验能获得成功的是( )
下列实验能获得成功的是( )
 下列实验能获得成功的是( )
下列实验能获得成功的是( )| A. | 用如图所示装置,无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色 | |
| C. | 水和乙醇的混合液,可用蒸馏的方法使其分离 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可观察到有银镜出现 |
15.如表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | Y氢化物的沸点一定比X氢化物的沸点高 | |
| B. | Z的最高价氧化物的水化物酸性比W的强 | |
| C. | XZ2、XW4 与Na2O的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在TZ2和TW4 |
12.下列物质中,含极性键和非极性键且分子有极性的是( )
| A. | 乙烯 | B. | 乙醛(CH3CHO) | C. | 甲醇 | D. | 三氯甲烷 |
9.苯的结构式可用 来表示,下列关于苯的叙述中正确的是( )
来表示,下列关于苯的叙述中正确的是( )
 来表示,下列关于苯的叙述中正确的是( )
来表示,下列关于苯的叙述中正确的是( )| A. | 苯是无色无味,密度比水大的液体 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯分子中6个碳碳化学键完全相同 | |
| D. | 苯可以与溴水、高锰酸钾溶液反应而使它们褪色 |
10.下列有关化学用语能确定为丙烯的是( )
| A. | CH2═CHCH3 | B. | C3H6 | C. |  | D. | CH2═CH3CH |