题目内容
15.为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和(CuSO4) |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 金属的金属性强弱判断方法:金属的金属性越强,其最高价氧化物的水化物碱性越强,活泼性较强的金属能置换出较不活泼金属,金属和酸或水反应越剧烈,据此分析解答.
解答 解:金属的金属性强弱判断方法:金属的金属性越强,其最高价氧化物的水化物碱性越强,活泼性较强的金属能置换出较不活泼金属,金属和酸或水反应越剧烈,
①将铁片置于CuSO4溶液中,铁片上有亮红色物质析出,Fe能置换出硫酸铜中的铜,说明金属性铁>铜,故正确;
②将铁丝和铜丝分别在氯气中燃烧,产物分别为FeCl3和CuCl2,Fe元素化合价变化大于Cu,不能根据金属失电子多少判断金属性强弱,故错误;
③将铁片和铜片分别放入热浓硫酸中产物分别为Fe2(SO4)3和CuSO4,Fe元素化合价变化大于Cu,不能根据金属失电子多少判断金属性强弱,故错误;
④将铁片和铜片分别置于稀硫酸溶液中,铁片上有气泡,铜片上不产生气泡,说明金属性Fe>Cu,故正确;
⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接,铁片溶解,铜片上有气泡产生,说明Fe能置换出氢气、铜不能置换出氢气,则金属性Fe>Cu,故正确;
故选B.
点评 本题考查金属性强弱判断方法,明确金属性强弱与金属失电子难易程度有关,与失电子多少无关,为易错题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.由铜、锌和稀硫酸组成的原电池中,下列各叙述正确的是( )
| A. | 溶液pH由大变小 | B. | 负极附近Zn2+浓度逐渐增大 | ||
| C. | H+向负极移动 | D. | 溶液中H2SO4的浓度不变 |
3.下列装置或操作不能达到实验目的是( )
| A. |  铁丝的析氢腐蚀实验 | B. | 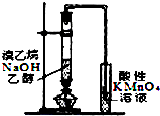 检验该反应的有机产物 | ||
| C. | 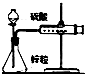 结合秒表测量锌与硫酸的反应速率 | D. | 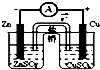 验证化学能转化为电能 |
20.不能用磨口玻璃瓶贮存的一组物质是( )
| A. | 溴水 氯水 碘水 | B. | 氢溴酸 盐酸 氢硫酸 | ||
| C. | 浓硫酸 浓硝酸 浓盐酸 | D. | NaOH溶液 Na2CO3溶液 水玻璃 |
7.下列事实中能说明亚硝酸(HNO2)是弱电解质的是( )
| A. | 0.1 mol•L-1的HNO2溶液中[H+]约为0.01 mol•L-1 | |
| B. | 用HNO2溶液做导电实验,灯泡很暗 | |
| C. | HNO2溶液不与Na2SO4溶液反应 | |
| D. | HNO2能与NaOH溶液发生中和反应 |
4.下列各组气体,在常温下能共存的是( )
| A. | NO和O2 | B. | NH3和HCl | C. | NH3和O2 | D. | H2S和SO2 |
5.下列离子方程式书写不正确的是( )
| A. | 往NaOH溶液中通入过量CO2:CO2+OH-═HCO3- | |
| B. | 往水玻璃中加入盐酸:SiO32-+2H+═H2SiO3↓ | |
| C. | 石英砂与烧碱反应制水玻璃:SiO2+2OH-═SiO32-+H2O | |
| D. | 往水玻璃中通入CO2:Na2SiO3+H2O+CO2═H2SiO3+2Na++CO32- |