题目内容
6.由铜、锌和稀硫酸组成的原电池中,下列各叙述正确的是( )| A. | 溶液pH由大变小 | B. | 负极附近Zn2+浓度逐渐增大 | ||
| C. | H+向负极移动 | D. | 溶液中H2SO4的浓度不变 |
分析 锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应,电极反应:Zn-2e-═Zn2+;铜作正极,正极上氢离子得电子发生还原反应电极方程式为2H++2e-=H2↑;电子从负极沿导线流向正极.
解答 解:A、铜作正极,正极上氢离子得电子生成氢气,所以溶液中H+的物质的量不断减小,pH增大,故A错误;
B、锌作负极,负极上锌失电子生成锌离子,锌离子浓度增大,故B正确;
C、原电池中阴离子移向负极,阳离子移向正极,氢离子移向正极,故C错误;
D、正极上氢离子得电子发生还原反应电极方程式为2H++2e-=H2↑,硫酸浓度减小,故D错误;
故选B.
点评 本题考查了原电池原理,难度不大,注意把握正负极的判断和电极方程式的书写以及离子的移动方向.

练习册系列答案
相关题目
19.关于元素周期表和元素周期律的应用有如下叙述:其中正确的是( )
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料.
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料.
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ②③ |
20.已知二氯苯的同分异构体有三种,从而可以推知四氯苯的同分异构体数目是( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
14.有一化学反应:aA+bB?C,根据影响化学反应速率的因素可得v0=kcm(A)cn(B),其中k是与温度有关的常数,为测得k、m、n的值,在298K时,将A、B溶液按不同浓度混合,得到下表中的实验数据:
(1)依表中数据可求得m=1,n=2,k=1.2×10-2,k的单位是L2•mol-2•s-1.
(2)若a=m,b=n,当c(A)=c(B)=2.0mol•L-1时,求以B表示的初始反应速率.
| 编号 | A的初$\frac{始浓度}{mol•{L}^{-1}}$ | B的初$\frac{始浓度}{mol•{L}^{-1}}$ | 生成C的$\frac{初始速率}{mol•{L}^{-1}•{s}^{-1}}$ |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 4.0 | 1.0 | 4.9×10-2 |
| 4 | 1.0 | 1.0 | 1.2×10-2 |
| 5 | 1.0 | 2.0 | 4.8×10-2 |
| 6 | 1.0 | 4.0 | 1.9×10-1 |
(2)若a=m,b=n,当c(A)=c(B)=2.0mol•L-1时,求以B表示的初始反应速率.
1.据报道,美国正在研究的锌电池可能取代目 前广泛使用的铅蓄电池,它具有容量大等优点,其电池反应为2Zn+O2═2ZnO,原料是锌粒、电解质溶液、空气.下列叙述中正确的是( )
| A. | Zn为正极 | B. | 负极反应式:O2+4H++4e-→2H2O | ||
| C. | 正极发生氧化反应 | D. | 电解液肯定不是强酸 |
18.按要求写出以下方程式:
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
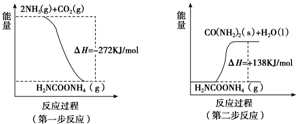
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式: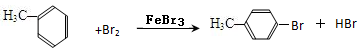 或
或
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式:
 或
或
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
15.为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和(CuSO4) |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
16.与0.1molH3PO4所含的氧原子数相同的是( )
| A. | 0.1molH2SO4 | B. | 0.2molH2SO3 | C. | 0.2molSO3 | D. | 0.3molCO2 |