题目内容
9.100mL 0.3mol•L -1K2SO4溶液和100mL 0.2mol•L -1 Al2(SO4)3溶液混合后,溶液中SO42─ 的物质的量浓度为(忽略溶液混合时的体积变化)( )| A. | 0.30 mol•L -1 | B. | 0.25mol•L -1 | C. | 0.50mol•L -1 | D. | 0.45mol•L -1 |
分析 根据n=cV计算K2SO4溶液和 Al2(SO4)3溶液中SO42- 的物质的量,混合后溶液中SO42- 的物质的量浓度等于SO42-的总物质的量除以溶液的总体积.
解答 解:100mL 0.3mol/L K2SO4溶液中SO42- 的物质的量为:0.1L×0.3mol/L=0.03moL,
100mL 0.2mol/L Al2(SO4)3溶液中SO42-的物质的量为:0.1L×0.2mol/L×3=0.06mol,
混合后溶液中SO42- 的总物质的量为:0.03moL+0.06mol=0.09mol,
溶液的总体积为:100ml+100ml=200ml,即0.2L,
所以混合后溶液中SO42- 的物质的量浓度为:$\frac{0.09mol}{0.2L}$=0.45mol/L,
故选D.
点评 本题考查物质的量浓度的计算,题目难度不大,注意对概念的理解与灵活应用.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
19.下列各种混合物中,不能用分液漏斗分离的是( )
| A. | 苯和水 | B. | 正己烷和水 | C. | 溴乙烷和水 | D. | 乙酸和乙醇 |
20.在无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | Mg2+、Ag+、NO3-、Cl- | B. | Cu2+、Na+、SO42-、Cl- | ||
| C. | Ba2+、K+、NO3-、Cl- | D. | Zn2+、Na+、OH-、SO42- |
4.金属晶体和离子晶体是重要晶体类型.下列关于它们的说法中,正确的是( )
| A. | 金属晶体和离子晶体都能导电 | |
| B. | 在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用 | |
| C. | 金属晶体和离子晶体都可采取“紧密堆积”方式,原子晶体都可采取“非紧密堆积”方式 | |
| D. | 金属晶体和离子晶体中分别存在金属键和离子键等相互作用,很难断裂,因而都具有延展性 |
1.下列分散系最稳定的是( )
| A. | 悬浊液 | B. | 乳浊液 | C. | 胶体 | D. | 溶液 |
1.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
实验原理2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验内容及记录
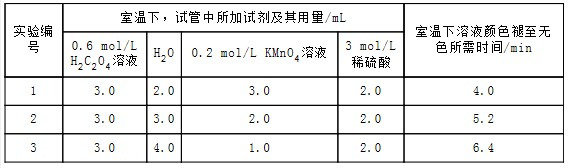
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
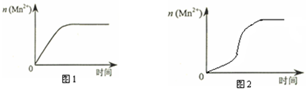
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短.
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为MnO42--e-=MnO4-;总方程式为2K2MnO4+2H2O═2KMnO4+2KOH+H2↑.
实验原理2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验内容及记录

请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4浓度反应速率增大.
(2)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=1.5×10-2mol/(L•min).
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
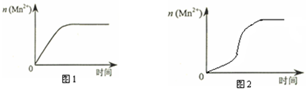
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用).
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
(4)工业上可用电解K2MnO4浓溶液的方法制取KMnO4,则电解时,阳极发生的电极反应为MnO42--e-=MnO4-;总方程式为2K2MnO4+2H2O═2KMnO4+2KOH+H2↑.
2.乙醇分子中各种化学键如图所示,下列有关反应断键位置说明错误的是( )


| A. | 乙醇和乙酸发生酯化反应时断键② | |
| B. | 乙醇和金属钠的反应断键① | |
| C. | 乙醇和浓硫酸,共热到170℃时断键②⑤ | |
| D. | 乙醇在Cu催化作用下与O2反应时断键①③ |