题目内容
【题目】氧化还原反应在生产、生活中应用广泛。下列反应不属于氧化还原反应的是( )
A. 木炭燃烧:C + O2 ![]() CO2
CO2
B. 加热碳酸镁:MgCO3 ![]() MgO + CO2 ↑
MgO + CO2 ↑
C. 铁的冶炼:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D. 电解水:2H2O![]() 2 H2 ↑ + O2 ↑
2 H2 ↑ + O2 ↑
【答案】B
【解析】
凡是有化合价发生变化的化学反应均为氧化还原反应,通过判断元素化合价是否变化来判断是否为氧化还原反应。
A. 木炭燃烧:C + O2 ![]() CO2,C、O元素的化合价发生变化,则为氧化还原反应,A项错误;
CO2,C、O元素的化合价发生变化,则为氧化还原反应,A项错误;
B. 加热碳酸镁:MgCO3 ![]() MgO + CO2 ↑,没有元素的化合价发生变化,则不是氧化还原反应,B项正确;
MgO + CO2 ↑,没有元素的化合价发生变化,则不是氧化还原反应,B项正确;
C. 铁的冶炼:Fe2O3+3CO![]() 2Fe+3CO2,C、Fe元素的化合价发生变化,则为氧化还原反应,C项错误;
2Fe+3CO2,C、Fe元素的化合价发生变化,则为氧化还原反应,C项错误;
D. 电解水:2H2O![]() 2 H2 ↑ + O2 ↑,H、O元素的化合价发生变化,则为氧化还原反应,D项错误;
2 H2 ↑ + O2 ↑,H、O元素的化合价发生变化,则为氧化还原反应,D项错误;
答案选B。

【题目】从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2(g)+O2(g)=2H2O(g)为放热反应,下图能正确表示该反应中能量变化的是_______ 。
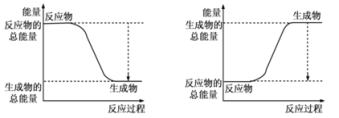
A B
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如上表:则生成1mol液态水可以放出热量____________kJ
(2)将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是______________, 正极的反应式为______________,电解质溶液中SO42- 移向______极(填“正”或“负”)。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为______ ;X为______ 。若反应经2min时C的浓度______ 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为______ ;X为______ 。若反应经2min时C的浓度______ 0.8mol/L(填“大于,小于或等于”)。