题目内容
7.下列对一些实验事实的理论解释正确的是( )| 选项 | 实验事实 | 理论解释 |
| A | 深蓝色的[Cu(NH3)4]SO4溶液中加入乙醇析出晶体 | 乙醇增强了溶剂的极性 |
| B | 用KSCN检验溶液中的Fe3+ | Fe3+遇SCN-生成血红色沉淀 |
| C | CH4熔点低于CO2 | 碳氢键比碳氧键的键长短、键能大 |
| D | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.络合物在乙醇中溶解度较小;
B.Fe3+遇SCN-生成血红色络合物;
C.熔沸点与分子间作用力有关;
D.原子轨道中电子处于全空、半满、全满时最稳定.
解答 解:A.[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,所以加入乙醇的目的是降低溶剂的极性,促使[Cu(NH3)4]SO4晶体析出,故A错误;
B.Fe3+遇SCN-生成血红色络合物而不是沉淀,故B错误;
C.熔沸点与分子间作用力有关,与共价键无关,分子间作用力越大,熔沸点越高,故C错误;
D.原子轨道中电子处于全空、半满、全满时最稳定,氮原子2p能级半充满,则氮原子的第一电离能大于氧原子,故D正确;
故选D.
点评 本题考查化学实验方案评价及原子结构和物质性质,为高频考点,明确实验原理、物质性质、物质和原子结构是解本题关键,注意络合物不是沉淀,注意:分子晶体熔沸点与氢键和分子间作用力有关,其稳定性与化学键有关.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气.若砷的质量为1.50mg,则下列说法正确的是( )
| A. | 被氧化的砒霜为1.98mg | B. | 分解产生的氢气为0.672ml | ||
| C. | 转移的电子总数为0.18NA | D. | 和砒霜反应的锌为3.90mg |
15.短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个电子,Z的价电子排布为3s23p3,W与X属于同一主族.下列叙述正确的是( )
| A. | 气态氢化物的热稳定性:X<W | |
| B. | 最高价氧化物对应水化物的酸性:W<Z | |
| C. | 电负性:Z<W | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
2.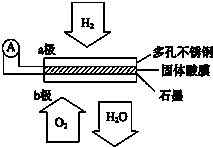 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )| A. | 电子通过外电路从b极流向a极 | |
| B. | b极上的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 每转移0.1 mol电子,消耗标准状况下1.12 L的H2 | |
| D. | OH-由a极通过固体酸电解质传递到b极 |
12.如图是蓝色晶体MxFey(CN)6中阴离子的最小结构单元(图中是该晶体晶胞的八分之一)下列说法正确的是( )
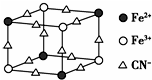

| A. | 该晶体属于离子晶体,M呈+2价 | |
| B. | 该晶体属于分子晶体,化学式为MFe2(CN)6 | |
| C. | 该晶体中与每个Fe3+距离相等且最近的CN-为12个 | |
| D. | 该晶体的一个晶胞中含有的M+的个数为4个 |
19.水中加入下列溶液对水的电离平衡不产生影响的是( )
| A. | NaHSO4溶液 | B. | NaCl溶液 | C. | KAl(SO4)2溶液 | D. | KF溶液 |
16.某金属的氧化物化学式为MxOy,那么该金属的氯化物的化学式为( )
| A. | MClx | B. | MCl2y/x | C. | MxCly | D. | MyClx |
17.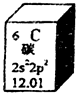 元素周期表是学习化学的重要工具,如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具,如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
 元素周期表是学习化学的重要工具,如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具,如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的原子序数为6 | |
| B. | 该元素所有原子的质子数均为6 | |
| C. | 该元素的原子质量为12.01 g | |
| D. | 该元素应有多种同位素,所有原子的中子数不都为6 |