题目内容
13.A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大.A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素.A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示.| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | B2A4 | D2C2 | A2E | DF |
(1)元素E在周期表中的位置第3周期第VIA族化合物丙的结构式为
 ,化合物甲的稳定性比戊高(填“高”或“低”) 化合物丁的化学键类型是离子键、共价键
,化合物甲的稳定性比戊高(填“高”或“低”) 化合物丁的化学键类型是离子键、共价键(2)用电子式表示己的形成过程:

(3)单质B与浓硝酸发生化学反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O
(4)向含有0.2mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为0.2 NA(NA代表阿伏加德罗常数)
分析 原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多2,原子只能有2个电子层,最外层电子数为4,则B为碳元素;B、A两种元素的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,A的原子序数小于碳,只能处于第一周期,可推知A为H元素;A与D同主族,则D为Na;F处于第三周期,F元素是同周期元素中原子半径最小的主族元素,则F为Cl;B、C同周期,C与E同主族,结合C与A形成的化合物A2C,可知C为O元素,则E为S元素,可推知甲为H2O、乙为H2O2、丙为C2H4、丁为Na2O2、戊为H2S、己为NaCl,据此解答.
解答 解:原子序数依次增大的A、B、C、D、E、F六种短周期元素,B原子最外层电子数比其次外层电子数多2,原子只能有2个电子层,最外层电子数为4,则B为碳元素;B、A两种元素的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,A的原子序数小于碳,只能处于第一周期,可推知A为H元素;A与D同主族,则D为Na;F处于第三周期,F元素是同周期元素中原子半径最小的主族元素,则F为Cl;B、C同周期,C与E同主族,结合C与A形成的化合物A2C,可知C为O元素,则E为S元素,可推知甲为H2O、乙为H2O2、丙为C2H4、丁为Na2O2、戊为H2S、己为NaCl.
(1)E为S元素,在周期表中的位置:第3周期第VIA族,化合物丙为C2H4,结构式为 ,由于非金属性O>S,故H2O稳定性比H2S的稳定性高,化合物丁为Na2O2,含有离子键、共价键,
,由于非金属性O>S,故H2O稳定性比H2S的稳定性高,化合物丁为Na2O2,含有离子键、共价键,
故答案为:第3周期第VIA族; ;高;离子键、共价键;
;高;离子键、共价键;
(2)己为NaCl,用电子式表示NaCl的形成过程: ,
,
故答案为: ;
;
(3)单质B为碳,与浓硝酸发生化学反应的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(4)向含有0.2molH2O2的水溶液中加入少量MnO2,发生反应:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,生成氧气为0.1mol,故转移电子数目为0.1mol×2=0.2mol,发生转移的电子数为0.2NA,
故答案为:0.2.
点评 本题考查元素化合物推断,充分利用短周期元素、核外电子排布特点、化合物中原子数目之比进行推断,难度中等.

 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 配制250mL4.6mol/L的稀硫酸需取该浓硫酸62.5mL | |
| C. | 该硫酸浓度太大,不能用于干燥氨气 | |
| D. | 硫酸的摩尔质量为98g |
| A. |  | B. |  | C. |  | D. |  |
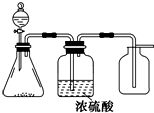 如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验室制气装置,用于制取、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 碱石灰和浓氨水 | B. | 锌和稀硫酸 | C. | 碳酸钙和稀盐酸 | D. | 铜和稀硝酸 |
| A. | 丙烷的球棍模型 | B. | N2的电子式  | ||
| C. | 甲烷的结构式为CH4 | D. | 乙烷的分子式 CH3CH3 |
| A. | 从反应开始到建立平衡所需时间:tA<tB | |
| B. | 平衡时I2的浓度:c(I2)A=c(I2)B | |
| C. | 平衡时碘蒸气在混合气体中的百分含量:A容器大于B容器 | |
| D. | 平衡时HI的分解率:αA=αB |
①所含分子数目之比为7:11 ②所含氧原子数目之比为11:14
③相同条件下体积之比为11:7 ④相同条件下密度值比为11:7.
| A. | ①和④ | B. | ②和③ | C. | ③和④ | D. | ②和④ |

下列说法不正确的是( )
| A. | 维生素C的分子式为C6H8O6 | B. | 滴定时可用淀粉溶液作指示剂 | ||
| C. | 滴定时应缓慢并轻轻的振荡锥形瓶 | D. | 上述反应为取代反应 |