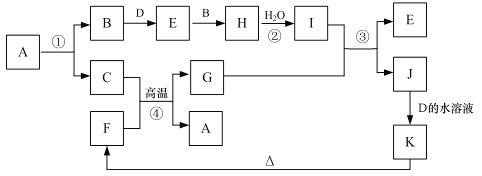
题目内容
【题目】(1)![]() 溶液呈碱性的原因是 ______
溶液呈碱性的原因是 ______ ![]() 写出有关的离子方程式
写出有关的离子方程式![]() ,将
,将![]() 溶液跟
溶液跟![]() 溶液混合,相关反应的离子方程式是 ______ .
溶液混合,相关反应的离子方程式是 ______ .
(2)现有浓度均为![]() 的
的![]() 溶液与
溶液与![]() 溶液,试回答下列问题:
溶液,试回答下列问题:
![]() 大小:
大小:![]() ______
______ ![]() 填
填![]() 、
、![]() 、
、![]() ;
;
![]() 微粒种类:
微粒种类:![]() ______
______ ![]()
![]() 填
填![]() 、
、![]() 、
、![]() ;
;
![]() 两溶液分别加入
两溶液分别加入![]() 固体,恢复到原温度,
固体,恢复到原温度,![]() 溶液中的
溶液中的![]()
______ ![]() 填“增大、减小或不变”
填“增大、减小或不变”![]() 、
、![]() 溶液中的
溶液中的![]() ______
______ ![]() 填“增大、减小或不变”
填“增大、减小或不变”![]() .
.
(3)常温下,甲为![]() 的HA溶液,
的HA溶液,![]() ;乙为
;乙为![]() BOH溶液,且溶液中
BOH溶液,且溶液中![]()
![]() 请分别写出甲、乙两溶液中溶质的电离方程式 ______ 、 ______ .
请分别写出甲、乙两溶液中溶质的电离方程式 ______ 、 ______ .
(4)相同条件下,对于浓度均为![]() 的NaCl溶液和
的NaCl溶液和![]() 溶液,溶液中的离子总数:NaCl溶液 ______
溶液,溶液中的离子总数:NaCl溶液 ______ ![]() 溶液
溶液![]() 填
填![]() 、
、![]() 、
、![]() .
.
(5)物质的量浓度相同的![]() 氨水
氨水![]() 氯化铵
氯化铵![]() 碳酸氢铵
碳酸氢铵![]() 硫酸氢铵
硫酸氢铵![]() 硫酸铵五种溶液中
硫酸铵五种溶液中![]() 由大到小的顺序是
由大到小的顺序是![]() 填写编号
填写编号![]() _____
_____
(6)浓度均为![]() 的6种溶液:
的6种溶液:![]()
![]()
![]()
![]()
![]()
![]() ,溶液pH值由小到大的顺序是
,溶液pH值由小到大的顺序是![]() 填写编号
填写编号![]() ______ .
______ .
(7)在钢铁发生的吸氧腐蚀中正极上的电极反应式为 ______ .
【答案】![]() 、
、![]()
![]()
![]()
![]() 增大 减小
增大 减小 ![]()
![]()
![]()
![]()
![]()
![]()
【解析】
![]() 碳酸钠是强碱弱酸盐,水解显碱性;
碳酸钠是强碱弱酸盐,水解显碱性;![]() 水解溶液呈碱性,
水解溶液呈碱性,![]() 在溶液中水解显酸性,二者混合发生相互促进的水解,生成二氧化碳和氢氧化铝;
在溶液中水解显酸性,二者混合发生相互促进的水解,生成二氧化碳和氢氧化铝;
![]() 酸
酸![]() 碱
碱![]() 越弱,则对应的盐的水解程度越大;
越弱,则对应的盐的水解程度越大;
![]() 的水解分两步,而
的水解分两步,而![]() 既能水解又能电离,据此分析离子种类;
既能水解又能电离,据此分析离子种类;
![]() 依据碳酸钠水解平衡分析,加入氢氧化钠增大氢氧根离子浓度,平衡左移;碳酸氢钠溶液中加入氢氧化钠溶液,氢氧根离子和碳酸氢根离子电离出的氢离子反应.促进电离正向进行;
依据碳酸钠水解平衡分析,加入氢氧化钠增大氢氧根离子浓度,平衡左移;碳酸氢钠溶液中加入氢氧化钠溶液,氢氧根离子和碳酸氢根离子电离出的氢离子反应.促进电离正向进行;
![]() 依据溶质浓度和溶液pH分析判断HA为弱酸,乙溶液中根据离子积常数和
依据溶质浓度和溶液pH分析判断HA为弱酸,乙溶液中根据离子积常数和![]() :
:![]() 计算溶液中的氢氧根离子浓度分析判断BOH是强碱还是弱碱;依据强电解质、弱电解质写出电离方程式;
计算溶液中的氢氧根离子浓度分析判断BOH是强碱还是弱碱;依据强电解质、弱电解质写出电离方程式;
![]() 醋酸钠溶液中醋酸根离子水解生成醋酸和氢氧根离子溶液中离子积是常数分析;
醋酸钠溶液中醋酸根离子水解生成醋酸和氢氧根离子溶液中离子积是常数分析;
![]() 依据溶质浓度不考虑水解计算铵根浓度比较大小,然后再依据其他离子对铵根离子水解平衡的影响,弱电解质电离程度小,铵根离子水解程度小;
依据溶质浓度不考虑水解计算铵根浓度比较大小,然后再依据其他离子对铵根离子水解平衡的影响,弱电解质电离程度小,铵根离子水解程度小;
![]() 吸氧腐蚀中,正极氧气得到电子生成氢氧根离子。
吸氧腐蚀中,正极氧气得到电子生成氢氧根离子。
![]() 碳酸钠是强碱弱酸盐,分步水解,水解离子方程式为:
碳酸钠是强碱弱酸盐,分步水解,水解离子方程式为:![]() 、
、![]() ;
;
![]() 水解,反应为:
水解,反应为:![]()
![]() ,溶液呈碱性;
,溶液呈碱性;![]() 水解,反应为:
水解,反应为:![]()
![]() ,
,![]() 溶液呈酸性;
溶液呈酸性;
![]() 溶液跟
溶液跟![]() 溶液混合,发生相互促进的水解:
溶液混合,发生相互促进的水解:![]() ,产生大量的气体和沉淀. 故答案为:
,产生大量的气体和沉淀. 故答案为:![]() 、
、![]() ;
;![]() ;
;
![]() 对应的酸为
对应的酸为![]() ,而
,而![]() 对应的酸为
对应的酸为![]() ,由于酸性
,由于酸性![]() ,而酸越弱,盐越水解,故
,而酸越弱,盐越水解,故![]() 的水解程度大于
的水解程度大于![]() 的水解程度,即
的水解程度,即![]() 溶液的碱性强于
溶液的碱性强于![]() 的碱性,则PH大小:
的碱性,则PH大小:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 的水解分两步进行:
的水解分两步进行:![]() ,
,![]() ,故
,故![]() 溶液中存在
溶液中存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,而
,而![]() 既能水解又能电离:
既能水解又能电离:![]() ,
,![]() ,故
,故![]() 溶液中存在
溶液中存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,所以两种溶液中微粒种类相同, 故答案为:
,所以两种溶液中微粒种类相同, 故答案为:![]() ;
;
![]() 依据碳酸钠水解平衡分析,加入氢氧化钠增大氢氧根离子浓度,平衡左移,碳酸根离子浓度增大;碳酸氢钠溶液中加入氢氧化钠溶液,氢氧根离子和碳酸氢根离子电离出的氢离子反应.促进电离正向进行,碳酸氢根离子浓度减小, 故答案为:增大;减小;
依据碳酸钠水解平衡分析,加入氢氧化钠增大氢氧根离子浓度,平衡左移,碳酸根离子浓度增大;碳酸氢钠溶液中加入氢氧化钠溶液,氢氧根离子和碳酸氢根离子电离出的氢离子反应.促进电离正向进行,碳酸氢根离子浓度减小, 故答案为:增大;减小;
![]() 甲为
甲为![]() 的HA溶液,
的HA溶液,![]() ,说明酸未完全电离,依据溶质浓度和溶液PH分析判断HA为弱酸,乙溶液中
,说明酸未完全电离,依据溶质浓度和溶液PH分析判断HA为弱酸,乙溶液中![]() ,根据离子积常数和
,根据离子积常数和![]() :
:![]() 计算溶液中的氢氧根离子浓度为:
计算溶液中的氢氧根离子浓度为:![]() ,分析判断BOH是强碱;依据弱电解质存在电离平衡写出电离方程式为:
,分析判断BOH是强碱;依据弱电解质存在电离平衡写出电离方程式为:![]() ,
,![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
![]() 醋酸钠溶液中醋酸根离子水解生成醋酸和氢氧根离子,溶液中离子积是常数,所以醋酸钠溶液中微粒数减小,故答案为:
醋酸钠溶液中醋酸根离子水解生成醋酸和氢氧根离子,溶液中离子积是常数,所以醋酸钠溶液中微粒数减小,故答案为:![]() ;
;
![]() 物质的量浓度相同的
物质的量浓度相同的![]() 氨水
氨水 ![]() 氯化铵
氯化铵 ![]() 碳酸氢铵
碳酸氢铵 ![]() 硫酸氢铵
硫酸氢铵 ![]() 硫酸铵五种溶液中,依据溶质浓度不考虑水解计算铵根浓度比较大小,然后再依据其他离子对铵根离子水解平衡的影响,弱电解质电离程度小,铵根离子水解程度小,
硫酸铵五种溶液中,依据溶质浓度不考虑水解计算铵根浓度比较大小,然后再依据其他离子对铵根离子水解平衡的影响,弱电解质电离程度小,铵根离子水解程度小,![]() 由大到小的顺序是:
由大到小的顺序是:![]() , 故答案为:
, 故答案为:![]() .
.
![]() 属于碱的为:
属于碱的为:![]() ;
;
水解呈碱性的为:![]() ,但由于水解程度较小,则pH:
,但由于水解程度较小,则pH:![]() ;
;
溶液呈中性的为:![]() ;
;
溶液呈酸性的有:![]() ,其中
,其中![]() 为一元强酸,
为一元强酸,![]() 为一元弱酸,
为一元弱酸,![]() 水解呈酸性,浓度相同时,溶液的pH:
水解呈酸性,浓度相同时,溶液的pH:![]() ,综合以上分析可知,溶液的pH由大到小的顺序是为:
,综合以上分析可知,溶液的pH由大到小的顺序是为:![]() , 故答案为:
, 故答案为:![]() ;
;
![]() 钢铁发生吸氧腐蚀的正极氧气得到电子生成氢氧根离子,正确的反应式为:
钢铁发生吸氧腐蚀的正极氧气得到电子生成氢氧根离子,正确的反应式为:![]() ,故答案为:
,故答案为:![]() .
.

【题目】亚硝酰氯![]() ,熔点:
,熔点:![]() ,沸点:
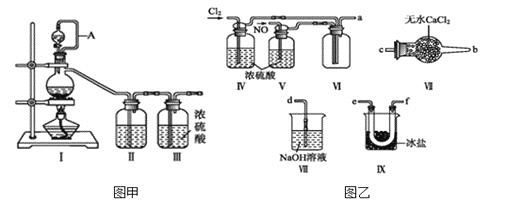
,沸点:![]() 为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示
为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水剧烈水解生成氮的两种氧化物与氯化氢,易溶于浓硫酸。是有机物合成中的重要试剂,常可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。其制备装置如图所示![]() 其中III、IV中均为浓硫酸
其中III、IV中均为浓硫酸![]() :
:
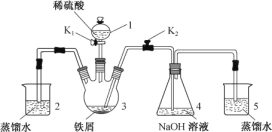
(1)用图甲中装置制备纯净干燥的原料气,补充下表中所缺少的药品。
| 装置Ⅰ | 装置Ⅱ | |
| 烧瓶中 | 分液漏斗中 | |
制备纯净 |
| 浓盐酸 |
|
制备纯净NO | Cu | 稀硝酸 |
|
(2)将制得的NO和![]() 通入图乙对应装置制备NOCl。
通入图乙对应装置制备NOCl。
![]() 装置连接顺序为
装置连接顺序为![]() ________
________![]() 按气流自左向右方向,用小写字母表示
按气流自左向右方向,用小写字母表示![]() 。
。
![]() 装置Ⅳ、Ⅴ除可进一步干燥NO、
装置Ⅳ、Ⅴ除可进一步干燥NO、![]() 外,还可以通过观察气泡的多少调节两种气体的流速。
外,还可以通过观察气泡的多少调节两种气体的流速。
![]() 有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、
有人认为可以将装置Ⅳ中浓硫酸合并到装置Ⅴ中,撤除装置Ⅳ,直接将NO、![]() 通入装置Ⅴ中,你同意此观点吗?_______
通入装置Ⅴ中,你同意此观点吗?_______![]() 填“同意”或“不同意”
填“同意”或“不同意”![]() ,原因是___________。
,原因是___________。
![]() 实验开始的时候,先通入氯气,再通入NO,原因为________________________。
实验开始的时候,先通入氯气,再通入NO,原因为________________________。
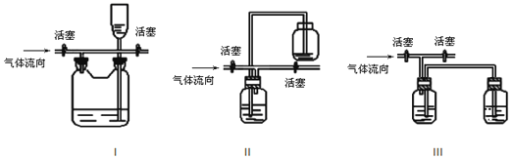
(3)有人认为多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______;
(4)装置Ⅶ吸收尾气时,NOCl发生反应的化学方程式为_______________________。
(5)有人认为装置Ⅶ中氢氧化钠溶液只能吸收氯气和NOCl,不能吸收NO,经过查阅资料发现用高锰酸钾溶液可以吸收NO气体,因此在装置Ⅶ氢氧化钠溶液中加入高锰酸钾,反应产生黑色沉淀,写出该反应的离子方程式:__________________________________。
(6)制得的NOCl中可能含有少量![]() 杂质,为测定产品纯度进行如下实验:称取
杂质,为测定产品纯度进行如下实验:称取![]() 样品溶于
样品溶于![]() 溶液中,加入几滴
溶液中,加入几滴![]() 溶液作指示剂,用足量硝酸酸化的
溶液作指示剂,用足量硝酸酸化的![]() 溶液滴定至产生砖红色沉淀,消耗
溶液滴定至产生砖红色沉淀,消耗![]() 溶液
溶液![]() 。则该样品的纯度为__________
。则该样品的纯度为__________![]() 保留1位小数
保留1位小数![]()