题目内容
13.将等物质的量的A、B混合于2L密闭容器中发生如下反应:3A(g)+B(g)?xC(g)+2D(g),4min时测得D的浓度为0.4mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L•min)列式计算:
(1)x=2
(2)B在这4min内的平均反应速率
(3)此时A的浓度及反应开始前容器中A、B的物质的量.
分析 (1)计算D的反应速率,根据化学反应速率之比等化学计量数之比进行计算得到x;
(2)化学反应速率之比等于化学方程式计量数之比;
(3)结合方程式,利用三段式进行计算,设开始前容器中A的物质的量为n,设开始前容器中A的物质的量为n,n(D)=0.4mol•L-1×2L=0.8mol,
3A(g)+B(g)?2C(g)+2D(g),
开始 n n 0 0
转化 1.2mol 0.4mol 0.8mol 0.8mol
5min n-1.2 n-0.4 0.8 0.8
则:(n-1.2):(n-0.4)=3:5,
解得:n=2.4mol,以此来解答.
解答 解:(1)v(D)=$\frac{0.4mol/L}{4min}$=0.1mol•L-1•min-1,v(C):v(D)=0.1mol•L-1•min-1:0.1mol•L-1•min-1=1:1=x:2,解得:x=2,
故答案为:2;
(2)化学反应速率与化学计量数成正比,则v(C):v(B)=2:1=0.1mol•L-1•min-1:v(B),解得:v(B)=0.05mol•L-1•min-1,
答:B的平均反应速率0.05mol•L-1•min-1;
(3)设开始前容器中A的物质的量为n,n(D)=0.4mol•L-1×2L=0.8mol,
3A(g)+B(g)?2C(g)+2D(g),
开始 n n 0 0
转化 1.2mol 0.4mol 0.8mol 0.8mol
5min n-1.2 n-0.4 0.8 0.8
则:(n-1.2):(n-0.4)=3:5,
解得:n=2.4mol,
此时A的浓度=$\frac{2.4mol-1.2mol}{2L}$=0.6mol/L,
答:此时A的浓度为0.6 mol/L,反应开始前放入容器中的A、B的物质的量2.4mol.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握化学反应速率与化学计量数的关系,试题培养了学生的分析能力及化学计算能力.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案| 元素 | X | Y | Z | W |
| 相关信息 | 元素周期表中核电荷数最小的元素 | 大气中含量最多的元素,其某些氧化物为大气中常见的污染物 | 地壳中含量最多的金属元素 | 原子最外层电子数是电子层数的二倍 |
| A. | X、Y、W三种元素不可能形成离子化合物 | |
| B. | Z的简单离子半径比Y的简单离子半径大 | |
| C. | 工业上常常通过电解Z的熔融氯化物的方法来获得Z的单质 | |
| D. | W的单质在氧气中燃烧火焰呈蓝紫色 |
(1)在一定条件下:2N2(g)+6H2O(g)═4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
(2)电厂烟气脱氮的主要反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)△H<0,副反应II:2NH3(g)+8NO(g)?5N2O(g)+3H2O(g)△H>0.
①反应I的化学平衡常数的表达式为$\frac{{C}^{6}({H}_{2}O){C}^{5}({N}_{2})}{{C}^{6}(NO){C}^{4}(N{H}_{3})}$.
②对于在2L密闭容器中进行的反应I,在一定条件下n(NH3)和n(N2)随时间变化的关系如图1所示:

用NH3表示从开始到t1时刻的化学反应速率为$\frac{a-b}{2{t}_{1}}$(用a、b、t表示)mol/(L•min),图中表示已达平衡的点为CD.
③电厂烟气脱氮的平衡体系的混合气体中N2和N2O含量与温度的关系如图2所示,在温度420~550K时,平衡混合气体中N2O含量随温度的变化规律是随温度升高,N2的含量降低,造成这种变化规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移.
(3)电化学降解法可治理水中硝酸盐的污染.电化学降解NO3-的原理如图3所示,电源正极为a(填“a”或“b”),阴极电极反应式为2NO3-+10e-+12H+=6H2O+N2↑.
| A. | Z的氢化物稳定性可能较差 | B. | Q、P中均含有非极性键 | ||
| C. | 对应单质失去电子的能力:W>Y>Z | D. | 单质熔点:Y>X>W |
①化学性质相似的有机物是同系物;
②分子组成相差一个或若干个CH2原子团的有机物是同系物;
③若烃中碳、氢元素的质量分数相同,它们必定是同系物;
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似;
⑤相对分子质量相同而结构不同的化合物互为同分异构体;
⑥石墨与金刚石分子式相同,结构不同,互为同分异构体.
| A. | ①②③④⑤⑥ | B. | 只有②③⑤ | C. | 只有③④⑥ | D. | 只有①②③⑥ |
| A. | 酒精 | B. | 碘酒 | C. | 水银 | D. | 黄金 |
| A. | m=2 | |
| B. | X与Y的转化率相等 | |
| C. | 该温度下的平衡常数约为9.3×10-3 | |
| D. | 重新建立平衡时Z的浓度为0.4mol•L-1 |
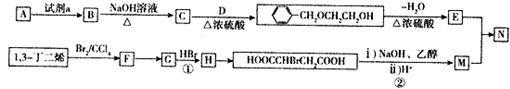
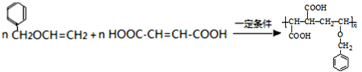 .
.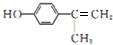 .
.